常温下,0.1m01/L的下列溶液:
①HCl、②CH3COOH、③CH3COONa、④NaOH、⑤FeCl3、⑥NaCl。
(1)pH由小到大排列顺序为 (填序号);
(2)实验室配制⑤的溶液时常需加入少量盐酸,否则得到的是浑浊的溶液,产生浑浊的原因是(用离子方程式表示)
(3)物质的量浓度相同的①氨水②氯化铵③碳酸氢铵④硫酸氢铵⑤硫酸铵
在上述五种溶液中,铵根离子物质的量浓度由大到小的顺序是
(4)已知拆开1molH—H键,1molN—H键,1molN≡N键分别需要的能量是436kJ、39l kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为
(1)①②⑤⑥③④ (2)Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
(3)⑤>④>②>③>① (4)N2(g)+3H2(g) 2NH3(g)
2NH3(g) 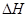 =-92.0kJ/mol
=-92.0kJ/mol
题目分析:(1)盐酸是一元强酸,醋酸是一元弱酸,醋酸钠是弱酸强碱盐,氢氧化钠是一元强碱。氯化铁是强酸弱碱盐,氯化钠是强酸强碱盐,所以在浓度相等的条件下,pH由小到大排列顺序为①②⑤⑥③④。
(2)氯化铁溶于水,铁离子水解生成氢氧化铁和盐酸,所以加入盐酸的目的是抑制铁离子的水解,方程式是Fe3++3H2O Fe(OH)3+3H+。
Fe(OH)3+3H+。
(3)在溶液中NH4+水解,而硫酸氢铵能电离出氢离子,抑制NH4+水解。HCO3-水解,显碱性,促进NH4+水解,所以五种溶液中,铵根离子物质的量浓度由大到小的顺序是⑤>④>②>③>①。
(4)反应热是断键吸收的能量和形成化学键所放出的能量的差值,则该反应的反应热△H=3×436kJ/mol+946kJ/mol-2×3×391kJ/mol=-92.0kJ/mol,所以反应的热化学方程式是N2(g)+3H2(g) 2NH3(g)
2NH3(g) 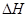 =-92.0kJ/mol。
=-92.0kJ/mol。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,差值对学生灵活运用基础知识解决实际问题的能量的培养。旨在提高学生分析、归纳、总结问题的能力。有利于调动学生的学习兴趣和学习积极性,也有助于培养学生的逻辑推理能力和抽象思维能力。
