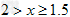某同学用下面装置实现铜与浓、稀硝酸反应,过程如下:
I.取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3]。
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状。
Ⅲ.按下图所示连接仪器、检查气密性、装入化学试剂。
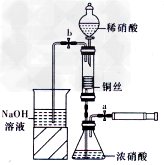
(1)过程I发生反应的离子方程式是__________________。
(2)过程Ⅱ将铜丝做成螺旋状的目的是______________________
(3)过程Ⅲ的后续操作如下:
①为使浓硝酸与铜丝接触.操作是_____________________。当红棕色气体较多时,轻抽注射器使反应停止,关闭a,取下注射器。
②换入另一注射器后,打开b和分液漏斗活塞,玻璃管充满稀硝酸时,关闭b打开a,可见无色气体产生。稀硝酸充满玻璃管的实验目的是_________________。
(4)已知:NO+NO2+2NaOH==2NaNO2+H2O;2NO2+2NaOH==NaNO3+NaNO2+H2O,NO和NO2的混合气体的组成可表示为NOx。将该混合气体通入NaOH溶液被完全吸收时,x的取值范围应为_________________。
(1)Cu2(OH)2CO3+4H+==2Cu2++CO2↑+3H2O
(2)增大铜丝与酸的接触面积,提高化学反应速率
(3)打开止水夹a和b,从注射器中推入空气;将玻璃管中的NO2排出
(4)