(11分)某化学小组设计实验探究碳酸钠、碳酸氢钠的性质,实验如下:取两支试管分别加入10 mL相同浓度的稀盐酸,将两个各装有0 5 g的Na2CO3和NaHCO3粉末的小气球分别套在两个试管上,将气球内的固体粉末同时倒人试管中,已知盐酸足量,观察实验现象。

(l)两支试管中均产生气体,其中产生气体较快的为________(填“试管I”或“试管II”),投入________(填化学式)的试管中气球变得比较大。
(2)甲同学触摸上述两试管,发现试管I变冷,试管Ⅱ变热,由此提出不管其状态如何,NaHCO3与HCl反应为吸热反应,Na2CO3与HCl反应为放热反应。
为进一步探究Na2CO3、NaHCO3与盐酸反应的能量变化,乙同学进行下列实验,操作步骤为:①向试剂1中加入试剂2,搅拌、测定温度;②静置、测定温度;③再加入试剂3.搅拌、测定温度、记录。得到以下数据:
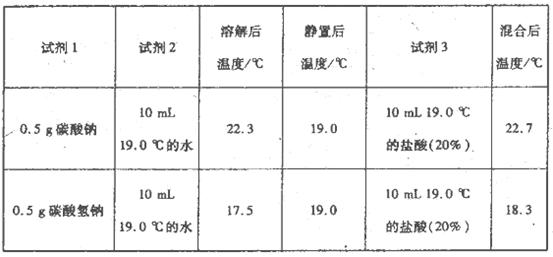
上述实验需要用到的玻璃仪器有________。
乙同学可得出结论:
①NaHCO3的溶解过程________(填“吸热”或“放热”,下同);Na2CO3的溶解过程________。
②CO32-与H+反应为一反应(填“放热”或“吸热”,下同),HCO3-与H+反应为________反应。
(3)比较甲乙同学的实验,你认为 ________(填“甲”或“乙”)的实验方案更合理、更严密。
(1)试管I;NaHCO3;
(2)烧杯、玻璃棒、温度计;①吸热、放热;②放热、吸热;
(3)乙
题目分析:(1)碳酸氢钠与碳酸钠与等浓度的盐酸反应,碳酸氢钠的反应速率快,因为碳酸氢钠只需结合1个氢离子就可生成二氧化碳气体,所以产生气体较快的是试管I,等质量的碳酸氢钠与碳酸钠与足量盐酸反应,碳酸氢钠产生的气体多,所以投入NaHCO3的试管中气球变得比较大。
(2)根据实验操作判断,需要的玻璃仪器是烧杯、玻璃棒、温度计;
①从表中数据可知当时室温是19.0ºC,碳酸氢钠溶解后温度低于19.0 ºC,说明碳酸氢钠的溶解过程吸热;同理碳酸钠的溶解过程是放热;
②碳酸钠与盐酸的反应分2步,CO32-+H+=HCO3-,HCO3-+ H+=H2O+CO2↑,由碳酸氢钠的反应温度判断HCO3-与H+反应为吸热反应,而碳酸钠与盐酸的反应是放热反应,所以碳酸钠与盐酸反应的第一步是放热反应;
(3)乙同学的实验方案更合理,甲同学的判断可能是因为溶解过程的热效应造成的温度的差异,不能说明是反应的热效应造成的,乙同学通过比较反应后的温度,判断反应的热效应,与甲相比更有说服力。
