问题
问答题
实验室用6.5g锌和200ml稀硫酸反应制取氢气.若恰好完全反应时计算:
(1)所用锌的物质的量
(2)在标准状况下产生氢气的体积
(3)该硫酸溶液中H+物质的量浓度.
答案
6.5g锌的物质的量为
=0.1mol,则6.5g 65g/mol
Zn+H2SO4=ZnSO4+H2↑
1mol 1mol 22.4L
0.1mol 0.1mol 2.24L
(1)6.5g锌的物质的量为
=0.1mol,答:所用锌的物质的量为0.1mol.6.5g 65g/mol
(2)由方程式可知生成氢气的体积为2.24L,
答:在标准状况下产生氢气的体积为2.24L.
(3)n(H+)=2n(H2SO4)=0.2mol,
c(H+)=
=1mol/L,0.2mol 0.2L
答:该硫酸溶液中H+物质的量浓度为1mol/L.

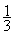 的体积露出油面(取g= 10 N/kg).求:
的体积露出油面(取g= 10 N/kg).求: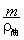 m3,1吨原油等于多少桶?
m3,1吨原油等于多少桶?