问题
填空题
I.1100℃时,在恒容密闭容器中,发生如下可逆反应: Na2SO4(s)+4H2(g)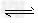 Na2S(s)+4H2O(g),并达到平衡。请完成下列各题:
Na2S(s)+4H2O(g),并达到平衡。请完成下列各题:
(1)达到平衡时的平衡常数表达式:K=________;降低温度,K值减小,则正反应为_________(填“吸热”或“放热”)反应。
(2)向该容器中分别加入以下物质,对平衡的影响如何?
①加入少量Na2SO4,则平衡____________(填所选字母,下同);
②加入少量灼热的Fe3O4,则平衡_____________。
a.正向移动 b.逆向移动 c.不发生移动
Ⅱ.将CH4设计成燃料电池,其利用率更高,装置示意如图 (A、B为多孔性碳棒),持续通入甲烷,在标准状况下,消耗甲烷体积VL。
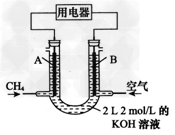
(1)0<V≤44.8 L时,电池总反应方程式为_____________;
(2)44.8 L<V≤89.6 L时,负极的电极反应式为__________;
(3)V =67.2 L时,溶液中阴离子浓度大小关系为________________
答案
Ⅰ. (1)c4 (H2O)/c4 (H2) ;吸热 ;a ;c
Ⅱ. (1)CH4+2O2+2KOH=K2CO3+3H2O
(2)CH4-8e-+9CO32- +3H2O=10HCO3-
(3)c(HCO3-)>c(CO32-)>c(OH-)
