问题
选择题
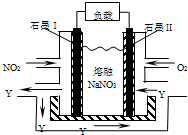
NO2、O2和熔融NaNO3可制作燃料电池,其原理见图,该电池在使用过程中石墨I电极上生成氧化物Y,下列说法不正确的是( )
A.石墨I附近发生的反应为NO2+NO3--e-═N2O5
B.石墨Ⅱ附近反生的反应为O2-4e-═2O2-
C.该电池放电时NO3-从右侧向左侧迁移
D.相同条件下,放电过程中消耗的NO2和O2的体积比为4:1
答案
A.石墨I为原电池的负极,发生氧化反应,电极方程式为NO2+NO3--e-═N2O5,故A正确;
B.石墨Ⅱ通入氧气,发生还原反应,为原电池的正极,电极方程式为O2+2N2O5+4e-═4NO3-,故B错误;
C.原电池工作时,阴离子向负极移动,故C正确;
D.电极方程式分别为NO2+NO3--e-═N2O5、O2+2N2O5+4e-═4NO3-,则放电过程中消耗的NO2和O2的体积比为4:1,故D正确.
故选B.
