(7分)硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ. SO2+2H2O+I2===H2SO4+2HI
Ⅱ. 2HI H2+I2
H2+I2
Ⅲ. 2H2SO4===2SO2+O2+2H2O
(1) 分析上述反应,下列判断正确的是_______________
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2) 一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
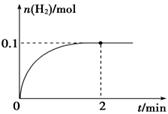
① 0~2 min内的平均反应速率v(HI)=________________
② 该温度下,H2(g)+I2(g)  2HI(g)的平衡常数K=__________________
2HI(g)的平衡常数K=__________________
③ 相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_____________是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3) 实验室用Zn和稀硫酸制取H2,反应时若加入少量下列试剂中的____________产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(1)C(1分)(2)①0.1mol/(L.min)(2分) ②64 (2分) ③b (1分)(3)b(1分)
题目分析:(1)H2SO4在常温下,很稳定不易分解,这是常识,所以a是错误的;反应Ⅰ中SO2是还原剂,HI是还原产物,因此还原性SO2>HI,所以b不正确;将Ⅰ和Ⅱ分别乘以2和Ⅲ相加得:2H2O==2H2+O2,所以c正确,d是错误的,答案选c。
(2)①因为 υ (H2)="0." 1mol/1L/2min="0.05" mol·L-1·min-1,所以根据反应速率之比是相应的化学计量数之比可知,υ (HI)="2" υ (H2)="0.1" mol·L-1·min-1。
② 2HI(g)==H2(g)+I2(g)
2 1 1
起始浓度/mol·L-1 1 0 0
变化浓度/mol·L-1: 0.2 0.1 0.1
平衡浓度/mol·L-1: 0.8 0.1 0.1
所以该可逆反应的平衡常数K= =64mol/L。
=64mol/L。
③如果开始时加入HI的量是用来的2倍,则建立的平衡状态和原平衡状态相比是等比破坏,因此HI、H2、I2的物质的量、平衡浓度都是原来的两倍;但铬组分的百分含量、体积分数、平衡常数都是不变的。由于开始时的浓度增大了,反应速率加快,达平衡的时间不可能是原来的两倍,所以答案选b。
(3)水是弱电解质,存在电离平衡H2O=H++OH-,硫酸电离出的氢离子对水的电离是抑制作用,当锌消耗了氢离子后,氢离子浓度降低,促进水的电离;如果加入硝酸钠,则溶液洗相当于是硝酸溶液,此时不再生成氢气;加入的亚硫酸氢钠会和氢离子反应,降低氢离子浓度,反应速率降低;硫酸钠的加入对反应速率是无影响的;加入硫酸铜后,锌与置换出的Cu构成原电池,加快了反应速率,所以答案选b。
点评:该题是2010年山东卷28题,在能力方面考查了“能够将实际问题分解,通过运用相关知识,采用分析、综合的方法解决简单化学问题的能力”、“能够将分析解决问题的过程和成果用正确的化学术语及文字、图表、模型、图形等表达,并作出解释的能力”。试题设置了考生比较陌生的情景——“硫——碘循环分解水制氢”,对考生的心理素质要求较高。
