分氨气是中学化学中常见的气体,其用途广泛。
(1)实验室制取氨气的化学方程式是 。
(2)工业上氨气可以由氢气和氮气合成。
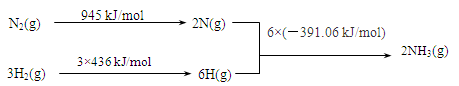
①该反应的热化学方程式是 。
②简述一种检查氨气是否泄露可采用的化学方法: 。
(3)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
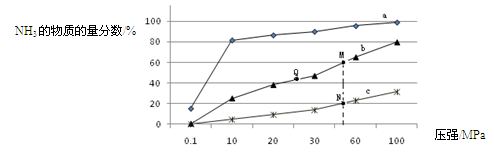
①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是 (填字母)。
A. 及时分离出NH3可以提高H2的平衡转化率
B. 加催化剂能加快反应速率且提高H2的平衡转化率
C. 上图中M、N、Q点平衡常数K的大小关系是K(M)=" K(Q)" >K(N)
③ M点对应的H2转化率是 。
(4)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用
氨水吸收法处理尾气。
① 当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L SO2时,溶液中的溶
质为 。
② (NH4)2SO3显碱性,用化学平衡原理解释 。
③ NH4HSO3显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确
的是 (填字母)。
a.c(NH4+) = 2c(SO32-) + c(HSO3-)
b.c(NH4+)> c(SO32-)> c(H+)= c(OH-)
c.c(NH4+)+ c(H+)= c(SO32-)+c(HSO3-)+c(OH-)
(5)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:
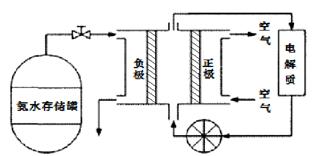
①氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液。
②空气在进入电池装置前需要通过过滤器除去的气体是 。
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池的电极总反应是 ,正极的电极反应方是 。
(1)2NH4Cl +Ca(OH)2△2NH3↑+CaCl2 +2H2O (1分)
(2)①N2(g) +3H2(g) 2NH3(g)
2NH3(g) 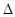 H= -93.36 kJ/mol (1分)
H= -93.36 kJ/mol (1分)
②将湿润的红色石蕊试纸接近容器,观察试纸是否变蓝,如果变蓝说明有氨气泄露。(或蘸取浓盐酸接近容器,观察是否有白烟生成,如果有白烟生成说明管道泄露。) (1分)
(3)① 200℃(1分) ② AC(1分) ③ 75%(1分)
(4)① (NH4)2SO3和NH4HSO3(1分)
② NH4+ + H2O NH3·H2O + H+ SO32-+H2O
NH3·H2O + H+ SO32-+H2O HSO3-+ OH-,SO32-水解程度大于NH4+的水解程度使溶液中c(OH-) > c(H+),溶液呈碱性。(1分)
HSO3-+ OH-,SO32-水解程度大于NH4+的水解程度使溶液中c(OH-) > c(H+),溶液呈碱性。(1分)
③ a b(2分)
(5)①碱性(1分 ②CO2(1分) ③ 4NH3+ 3O2= 2N2 + 6H2O (1分)
3O2 + 12e-+ 6H2O = 12OH-(1分)或 O2 + 4e-+ 2H2O = 4OH-
题目分析:(1)实验室制取氨气的化学方程式是2NH4Cl +Ca(OH)2△2NH3↑+CaCl2 +2H2O。
(2)①该反应的△H="945" kJ/mol+3×(436 kJ/mol)-6×(-391.06 kJ/mol)=-93.36 kJ/mol。
②检查氨气是否泄露有:将湿润的红色石蕊试纸接近容器,观察试纸是否变蓝,如果变蓝说明有氨气泄露。(或蘸取浓盐酸接近容器,观察是否有白烟生成,如果有白烟生成说明管道泄露。
(3)①曲线a的NH3的物质的量分数最大,而合成氨为放热反应,故对应的温度最低,是200℃。
②A.及时分离出NH3可以使平衡正向移动,可以提高H2的平衡转化率;
B. 加催化剂能加快反应速率,但不能破坏破坏,不能提高H2的平衡转化率;
C.合成氨为体积缩小的反应,压强越高平衡常数K越大,故K(M)=" K(Q)" >K(N)。
③N2(g) +3H2(g) 2NH3(g)
2NH3(g)
1 3 0
变化:1x 3x 2x
M点对应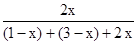 =60%,H2转化率75%。
=60%,H2转化率75%。
(4)① 当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L即2molSO2时,溶液中的溶
质含NH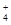 与S的个数比为3:2,故是1:1的(NH4)2SO3和NH4HSO3。
与S的个数比为3:2,故是1:1的(NH4)2SO3和NH4HSO3。
② (NH4)2SO3显碱性,是SO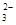 水解的缘故。
水解的缘故。
③ NH4HSO3显酸性。用氨水吸收SO2,当吸收液显中性时,
a.因为c(NH4+)+ c(H+)= 2c(SO32-) + c(HSO3-)+ c(OH-),中性得出c(NH4+) = 2c(SO32-)+ c(HSO3-);
b.NH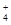 为盐直接电离的离子,SO
为盐直接电离的离子,SO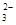 是HSO
是HSO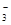 电离的离子,即c(NH4+)> c(SO32-);
电离的离子,即c(NH4+)> c(SO32-);
c.由电荷守恒:c(NH4+)+ c(H+)="2" c(SO32-)+c(HSO3-)+c(OH-)
(5)③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体是N2和水,即4NH3+ 3O2= 2N2 + 6H2O,正极的电极反应方是O2 + 4e-+ 2H2O = 4OH-
