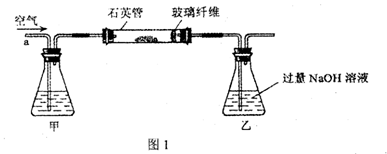
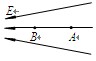
(10分)电场中某区域的电场线如图所示, A、B是电场中的两点. 一个电荷量q = +4.0×10-8 C的点电荷在A点所受电场力FA=2.0×10-4 N,将该点电荷从A点移到B点,电场力做功WAB= 8.0×10-7J .
求:(1)A点电场强度的大小EA
(2)A、B两点间的电势差UAB.
(1)5.0×103 N/C(2)20 V
题目分析:(1)A点电场强度的大小
EA =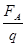
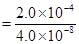 N/C =5.0×103 N/C………………5分
N/C =5.0×103 N/C………………5分
(2)A、B两点间的电势差
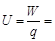
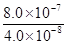 V =" 20" V……………………………5分
V =" 20" V……………………………5分
点评:在运用公式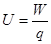 时一定要注意公式中各个量的正负号,不能丢去
时一定要注意公式中各个量的正负号,不能丢去