(16分)黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料。某化学学习小组对黄铁矿石进行如下实验探究:
[实验一]为测定硫元素的含量
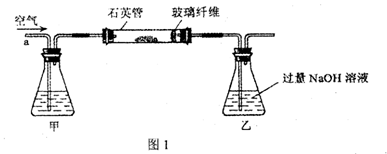
I.将m1g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。
II.反应结束后,将乙瓶中的溶液进行如图2处理。
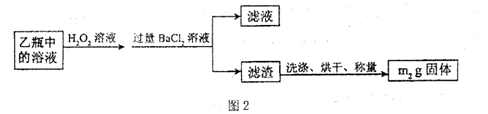
[实验二]测定铁元素的含量。III。测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL(该反应中还原产物为Mn2+)
请完成下列填空:
(1)已知12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的化学方程式是 。
(2)I中,甲瓶内所盛试剂是 溶液;乙瓶内发生反应的离子方程式有 ;I中玻璃纤维的作用是 。
(3)II中,所加H2O2溶液需足量的理由是 。
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有 ;
(5)该黄铁矿中硫元素的质量分数 (用I、II中有关实验数据表达);该黄铁矿中铁的元素的质量分数 (用I、II中有关实验数据表达)
(1)FeS2(s) + 11/4 O2 (g)= 1/2Fe2O3(s) + 2SO2(g) △H=-853KJ/mol
(2) NaOH , SO2 + 2OH- = SO32- + H2O 防止粉尘进入导管和乙装置
(3)使SO32-全部氧化SO42-
(4)250ml容量瓶 胶头滴管量筒
(5)32m2/233m1×100% 2.8CV/m11×100%
I.黄铁矿灼烧的化学方程式为:FeS2+ 11/4 O2 = 1/2Fe2O3+ 2SO2,由题目所给数据可计算出1molFeS2完全反应所放出的热量为853kJ,则热化学方程式为:FeS2(s) + 11/4 O2 (g)= 1/2Fe2O3(s) + 2SO2(g) △H=-853KJ/mol
(2)I中,甲瓶内所盛试剂是为了吸收SO2,一般用碱液NaOH溶液:SO2 + 2OH- = SO32- + H2O;I中玻璃纤维主要是为了防止粉尘进入导管和乙装置,以防造成实验误差
(3)乙中为亚硫酸盐,加入过量双氧水是为了将SO32-全部氧化SO42-
(4)将滤液稀释至250mL主要应用容量瓶进行操作,期间需要用到胶头滴管、量筒等仪器
(5)由S~BaSO4可知,硫元素的质量分数为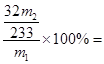 32m2/233m1×100%
32m2/233m1×100%
由5Fe~5Fe2+~KMnO4可知,铁元素的质量分数为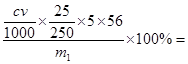 2.8cV/m1×100%
2.8cV/m1×100%
