铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:________(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为________。在实验室中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为______;
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________;与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________,该电池总反应的离子方程式为________。
(1)n(Cl)=0.0250 L×0.40 mol·L-1=0.010 mol,0.54 g-0.010 mol×35.5 g·mol-1=0.185 g,n(Fe)=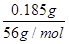 ≈0.0033 mol,n(Fe):n(Cl)=0.0033:0.010≈1:3,x=3
≈0.0033 mol,n(Fe):n(Cl)=0.0033:0.010≈1:3,x=3
(2)0.1;HCl;Cl2
(3)2Fe3++2I-=2Fe2++I2 (4)2Fe(OH)3+4OH-+3ClO-=2FeO42-+3Cl-+5H2O;
FeO42-+3e-+4H2O=Fe(OH)3+5OH-;
3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-
(1)n(H+)=n(OH-)=n(Cl-)=0.40 mol·L-1×25.0×10-3 L=0.010 mol,0.54 g样品中m(Cl)=0.010 mol×35.5 g·mol-1=0.355 g,则m(Fe)=0.54 g-0.355 g=0.185 g,n(Fe)=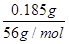 ≈0.0033 mol,故n(Fe):n(Cl)=0.0033:0.010≈1:3,所以x=3。(2)根据题意得
≈0.0033 mol,故n(Fe):n(Cl)=0.0033:0.010≈1:3,所以x=3。(2)根据题意得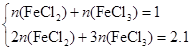 则
则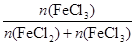 =0.1;氯气具有强氧化性,可将铁直接氧化为+3价,而盐酸的氧化性较弱。(3)Fe3+有较强的氧化性,能将I-氧化成单质,相应离子方程式为:2Fe3++2I-=I2+2Fe2+。(4)在强碱性溶液中,Fe3+以Fe(OH)3形式存在,KClO氧化Fe(OH)3后本身会被还原为Cl-,由题设条件可先写出:Fe(OH)3+ClO-―→FeO42-+Cl-,依据得失电子守恒配平上述四种离子:2Fe(OH)3+3ClO-―→2FeO42-+3Cl-+H2O、再结合电荷守恒及介质是碱性的可得到:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O。K2FeO4在正极上得到电子被还原为Fe3+,FeO42-+3e-+4H2O=Fe(OH)3+5OH-;电池工作后,锌转化为Zn(OH)2,故总反应为:2FeO42-+3Zn+8H2O=2Fe(OH)3+3Zn(OH)2+4OH-。
=0.1;氯气具有强氧化性,可将铁直接氧化为+3价,而盐酸的氧化性较弱。(3)Fe3+有较强的氧化性,能将I-氧化成单质,相应离子方程式为:2Fe3++2I-=I2+2Fe2+。(4)在强碱性溶液中,Fe3+以Fe(OH)3形式存在,KClO氧化Fe(OH)3后本身会被还原为Cl-,由题设条件可先写出:Fe(OH)3+ClO-―→FeO42-+Cl-,依据得失电子守恒配平上述四种离子:2Fe(OH)3+3ClO-―→2FeO42-+3Cl-+H2O、再结合电荷守恒及介质是碱性的可得到:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O。K2FeO4在正极上得到电子被还原为Fe3+,FeO42-+3e-+4H2O=Fe(OH)3+5OH-;电池工作后,锌转化为Zn(OH)2,故总反应为:2FeO42-+3Zn+8H2O=2Fe(OH)3+3Zn(OH)2+4OH-。
