问题
选择题
下图是甲醇/过氧化氢燃料电池内部结构示意图。工作时,甲醇和过氧化氢分别进入燃料电池的燃料腔和氧化剂腔,在各自催化剂的作用下发生反应,并向外界输出电能。下列说法正确的是
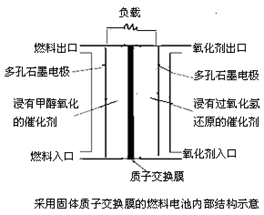
A.该电池的正极反应式:H2O2+2H++2e-=2H2O
B.燃料腔中的多孔石墨电极为该燃料电池的正极
C.电池工作时,1mol甲醇被还原有6mol电子转移
D.电路中的电子经正极、负极、质子交换膜后再回到正极,形成闭合回路
答案
答案:A
分析:由燃料电池内部结构示意图可知,电极材料为石墨,通入甲醇的一极为原电池的负极,发生氧化反应,电极反应式为CH3OH-6e-+H2O=CO2+6H+,正极加入H2O2,发生还原反应,电极反应式为H2O2+2H++2e-=2H2O,结合原电池的工作原理解答该题.
解:A.正极加入H2O2,发生还原反应,电极反应式为H2O2+2H++2e-=2H2O,故A正确;
B.燃料腔中的多孔石墨电极为该燃料电池的负极,故B错误;
C.负极电极方程式为CH3OH-6e-+H2O=CO2+6H+,电池工作时,1mol甲醇被氧化有6mol电子转移,故C错误;
D.电路中的电子经负极经外电路流向正极,故D错误.
故选A.
