碱式碳酸铜是一种用途广泛的化工原料。工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如下:
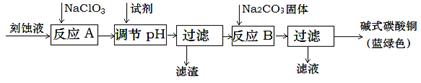
Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
(1)氯酸钠的作用是 ;滤渣的主要成分是 (写化学式)。
(2)调节反应A后溶液的pH范围应为 。可以选择的试剂是 (填序号)。
a.氨水 b.稀硫酸 c.氢氧化钠 d.碳酸铜
(3)反应B的温度如过高,则所得蓝绿色产品中可能会出现的杂质是 。(写化学式)
(4)过滤得到的产品洗涤时,如何判断产品已经洗净? 。
(5)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀。
① 若沉淀只有CuCO3,则相应的离子方程式为 。
② 若沉淀只有Cu(OH)2,用相应的离子方程式表示其过程 。
③ 若生成Cu(OH)2和CuCO3的混合物(即碱式盐)。则说明 。
(6)碱式碳酸铜组成可表示为:aCuCO3•bCu(OH)2•cH2O,现通过下列方案测定其组成。步骤如下:
① 称量样品;② 高温分解;③ 测出CO2的质量;④ 测出水蒸汽的质量;⑤ 称量CuO。
请对上述测定方案作出评价。 。
(1)将Fe2+氧化成Fe3+并最终除去(1分);Fe(OH)3(1分);(2)3.2-4.2(1分);d(1分);(3)CuO(1分);(4)取最后一次洗涤液,加入硝酸银、稀硝酸,无沉淀生成则表明已洗涤干净,其它合理答案也给分(1分)。(5)①Cu2++CO32-→CuCO3↓(1分);
②CO32-+H2O OH-+HCO3-,Cu2++2OH-→Cu(OH)2↓(2分);
OH-+HCO3-,Cu2++2OH-→Cu(OH)2↓(2分);
③碳酸铜与氢氧化铜的溶解度相近。(1分)(6)实验只需测定四个量中的三个即可。(2分)
题目分析:(1)氯酸钠的作用是将Fe2+氧化成Fe3+并最终除去;滤渣的主要成分是Fe(OH)3。(2)调节反应A后溶液的pH范围应为3.2-4.2。可以选择的试剂是碳酸铜,且不引进新的杂质。(3)反应B的温度如过高,碱式碳酸铜可能会出现的杂质是氧化铜。(4)取最后一次洗涤液,加入硝酸银、稀硝酸,无沉淀生成则表明已洗涤干净。(5)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀。① 若沉淀只有CuCO3,则相应的离子方程式为Cu2++CO32-=CuCO3↓。② 若沉淀只有Cu(OH)2,用相应的离子方程式表示其过程CO32-+H2O OH-+HCO3-,Cu2++2OH-→Cu(OH)2↓。③ 若生成Cu(OH)2和CuCO3的混合物(即碱式盐)。则说明碳酸铜与氢氧化铜的溶解度相近。。(6)碱式碳酸铜组成可表示为:aCuCO3•bCu(OH)2•cH2O,现通过下列方案测定其组成。步骤如下:① 称量样品;② 高温分解;③ 测出CO2的质量;④ 测出水蒸汽的质量;⑤ 称量CuO。实验只需测定四个量中的三个即可。。
OH-+HCO3-,Cu2++2OH-→Cu(OH)2↓。③ 若生成Cu(OH)2和CuCO3的混合物(即碱式盐)。则说明碳酸铜与氢氧化铜的溶解度相近。。(6)碱式碳酸铜组成可表示为:aCuCO3•bCu(OH)2•cH2O,现通过下列方案测定其组成。步骤如下:① 称量样品;② 高温分解;③ 测出CO2的质量;④ 测出水蒸汽的质量;⑤ 称量CuO。实验只需测定四个量中的三个即可。。
