(17分)随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题。
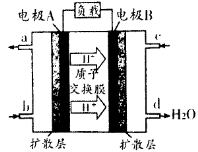
(1)汽车尾气的大量排放是造成空气污染的重要因素之一,发展燃料电池汽车可以有效地解决上述问题。直接甲醇燃料电池(DMFC)不会产生有害产物,能量转换效率比内燃机要高2~3倍,电池结构如图所示,c处通入的物质为为______,外电路中电子从______到______(填“A”或“B”)移动,写出电池负极的电极反应方程式
(2)工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是处理铬污染的常用方法。该法用Fe做电极电解含Cr2O72-的酸性废水,电解时,在阴极上有大量气泡生成,并产生Cr(OH)3、Fe(0H)3沉淀。
①反应中,1molCr2O72-完全生成Cr(OH)3沉淀,外电路通过电子的物质的量为_________ mol。
②常温下,Cr(OH)3的溶度积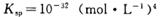 ,当Cr3+浓度小于10
,当Cr3+浓度小于10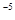 mol
mol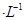 时可认为完全沉淀,电解完全后,测得溶液的pH=6,则该溶液过滤后为___________(填“能”或“否”)直接排放。
时可认为完全沉淀,电解完全后,测得溶液的pH=6,则该溶液过滤后为___________(填“能”或“否”)直接排放。
(3)含氨废水易引发水体富营养化。向NH4Cl溶液中加入少量NaOH固体,溶液中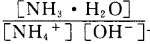 ________(填“增大”“减小”或“不变”);25
________(填“增大”“减小”或“不变”);25 时,NH3•H2O的电离平衡常数
时,NH3•H2O的电离平衡常数 ,该温度下,1mol
,该温度下,1mol 的NH4Cl溶液中
的NH4Cl溶液中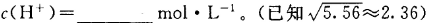
(17分)
(1)O2(2分) AB(2分) CH3OH—6e‾+H2O=CO2+6H+(3分)
(2)①12(3分) ②能(2分)
(3)不变(2分) 2.36×10-5(3分)
题目分析:(1)电池内部阳离子向正极移动,根据题目所给示意图,H+向电解B移动,则电极B为正极,所以C处通入的物质为O2;外电路电子从负极向正极移动,所以从A到B移动;根据示意图可知电解液中含H+,负极上甲醇失去电子生成CO2和H+,所以电极方程式为:CH3OH—6e‾+H2O=CO2+6H+
(2)①处理铬污染的原理是Fe做阳极发生反应:Fe—2e‾=Fe2+,Cr2O72‾氧化Fe2+,Cr2O72‾被还原为Cr3+,根据化合价的变化,对应关系为:Cr2O72‾~ 6Fe2+ ~6Fe,1molCr2O72-完全生成Cr(OH)3沉淀,阳极反应的Fe为6mol,外电路通过电子的物质的量为12mol。
②溶液的pH=6,则c(OH‾)=10-8mol•L‾1,带入溶度积公式可得:c(Cr3+)(10-8mol•L‾1)3=10-32(mol•L‾1)4,解得c(Cr3+)=10-8mol•L‾1 < 10-5mol•L‾1,能直接排放。
(3) 为NH4+水解平衡常数的倒数,NH4Cl溶液中加入少量NaOH,平衡常数不变,则该比值不变;根据盐类的水解与弱电解质电离的关系,水解平衡常数Kh=Kw/Kb=1.0×10-14mol2/L2÷(1.8×10-5mol•L‾1)=5.56×10-10mol•L‾1,则c(NH3•H2O)•c(H+)/c(NH4+)=5.56×10-10mol•L‾1,因为c(NH3•H2O)≈c(H+),c(NH4+)≈1mol•L‾1,带入计算式可得c(H+)=2.36×10-5mol•L‾1。
为NH4+水解平衡常数的倒数,NH4Cl溶液中加入少量NaOH,平衡常数不变,则该比值不变;根据盐类的水解与弱电解质电离的关系,水解平衡常数Kh=Kw/Kb=1.0×10-14mol2/L2÷(1.8×10-5mol•L‾1)=5.56×10-10mol•L‾1,则c(NH3•H2O)•c(H+)/c(NH4+)=5.56×10-10mol•L‾1,因为c(NH3•H2O)≈c(H+),c(NH4+)≈1mol•L‾1,带入计算式可得c(H+)=2.36×10-5mol•L‾1。
