(8分)某兴趣小组的同学为分析一种石灰石样品中碳酸钙的质量分数,取20g样品放入烧杯,把60g稀盐酸分三次加入烧杯,使其充分反应(样品中所含杂质既不溶于水也不与稀盐酸反应),实验流程及数据如下(所有实验数据都不包括烧杯的质量,且不考虑H2O和HCl的挥发;操作X包括搅拌、过滤、洗涤、干燥、称量):
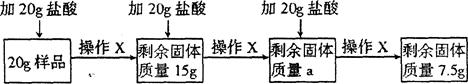
请回答:
(1)CaCO3中Ca与C的质量比为 ;
(2)实验时判断已充分反应的现象是 :其中a为 g;样品中碳酸钙的质量分数为 ;
(3)第三次反应过滤后所得溶液的pH 7(填“>”、“<”或“=”);为使该溶液
显中性且得到尽可能多的CaCl2,最后可向烧杯中加入过量的 (填序号)
A.CaO
B.CaCO3
C.Ca(OH)2
D.CaCl2(4)计算所用稀盐酸中溶质的质量分数(写出计算过程)
⑴10:3
⑵不再产生气泡 10 62.5%
⑶< B
⑷18.25%
根据碳酸钙的化学式为CaCO3,利用相对原子质量来计算相对分子质量、元素的质量比,由题意可知20g稀盐酸恰好能与石灰石中的5g碳酸钙完全反应,
由把60g稀盐酸分三次加入烧杯,使其充分反应,可知第二次加入20g稀盐酸也是反应了5g 的碳酸钙。a=15g-5g=10g,剩余固体质量7.5g为杂质,碳酸钙的质量=20g-7.5g=12.5g,进行分析解答
⑷由题意可知20g稀盐酸恰好能与石灰石中的5g碳酸钙完全反应
设20g稀盐酸中氯化氢的质量为xg
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
5g xg
100/5g=73/xg
X=3.65g
所用稀盐酸中溶质的质量分数=3.65g/20g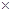 100%=18.25%
100%=18.25%
