下表是不同温度下水的离子积常数:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | KW | 1×10-12 |
(1)若25℃<t1<t2,则KW__________1×10-14(填“>”、“<”或“=”),判断的理由是
。
(2)25℃ 下,将pH=13的氢氧化钠溶液与pH=1的稀盐酸等体积混合,所得混合溶液的pH=__________。
(3)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”、“中性”或“碱性”),溶液中c(Na+) c(CH3COO-)(填“>”、“=”或“<”)。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 性(填“酸”、 “中”或“碱”),溶液中c(Na+) c(CH3COO-)[填“>”、“=”或“<”] 。
(1) > 因为水的电离是吸热反应,温度升高,水的电离程度增大,离子积也增大
(2) 7 (3) 碱性 > (4)酸性 <
题目分析:(1)水的电离过程是一个吸热过程,因此,升高温度,促进电离,相应的水的离子积常数也随之增大。
(2)25℃下水的离子积常数为1×10-14,则pH=13的氢氧化钠溶液与pH=1的稀盐酸等体积混合,所得混合溶液的pH为7.
(3)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后所得溶液的溶质为CH3COONa,为强碱弱酸盐,其对应的溶液显碱性。由于CH3COO-的水解,因此c(Na+)>c(CH3COO-)。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后所得溶液溶质为CH3COOH、CH3COONa。且c(CH3COOH)>c(CH3COONa),溶液显酸性,由于溶液中CH3COOH的电离,因此c(Na+)<c(CH3COO-)。
点评:本题所考查的都是基础题,熟练掌握课本的基础内容即可很好的解答。此题中应注意一个问题:“pH=3的醋酸”中由于醋酸是弱酸,因此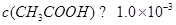 。
。
