问题
选择题
锌粉、铝粉、镁粉的混合物3.8g与一定质量的稀硫酸恰好完全反应,将反应后的混合物蒸发水份得固体硫酸锌、硫酸铝、硫酸镁混合物11g,则反应中生成氢气的质量为
A.0.15g
B.0.20g
C.0.30g
D.0.45g
答案
答案:A
题目分析:由题意可知,硫酸锌、硫酸铝、硫酸镁混合物中硫酸根的质量为11g-3.8g=7.2g。
设,硫酸的质量为X。X·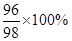 =7.2g,X=7.35g;反应产生的氢气的质量就是硫酸中的氢元素的质量,即7.35g×
=7.2g,X=7.35g;反应产生的氢气的质量就是硫酸中的氢元素的质量,即7.35g×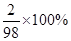 =0.15g。选A。
=0.15g。选A。
点评:解答本题的关键是理解硫酸锌、硫酸铝、硫酸镁混合物中硫酸根的质量为11g-3.8g=7.2g,根据化合物中元素的质量分数计算出硫酸的质量,再由此来计算氢气的质量。
