问题
填空题
在△ABC中,AB=AC=41cm,BC=80cm,AD为∠A的平分线,则S△ABC=______。
答案
360cm2
题目分析:依题意知在△ABC中,AB=AC=41cm,则△ABC为等腰三角形,AB、AC为腰,BC为底边。已知AD为∠A的平分线,根据等腰三角形三线合一可知AD⊥BC。
故S△ABC=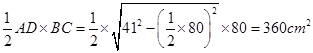
点评:本题难度中等,主要考查学生对等腰三角形三线合一性质知识点的掌握,为解题关键。
在△ABC中,AB=AC=41cm,BC=80cm,AD为∠A的平分线,则S△ABC=______。
360cm2
题目分析:依题意知在△ABC中,AB=AC=41cm,则△ABC为等腰三角形,AB、AC为腰,BC为底边。已知AD为∠A的平分线,根据等腰三角形三线合一可知AD⊥BC。
故S△ABC=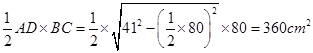
点评:本题难度中等,主要考查学生对等腰三角形三线合一性质知识点的掌握,为解题关键。