某校化学兴趣小组为测定空气中二氧化硫的含量,用NaOH溶液吸收SO2,反应的方程式如下:2NaOH+SO2═Na2SO4+H2O.用NaOH溶液吸收100L已除去CO2的空气样品,溶液质量增加了0.64g.已知此时空气的密度为1.3g/L,求:
(1)被吸收的SO2的质量.
(2)发生反应的NaOH的质量.
(3)空气中SO2的质量分数(计算结果精确到0.01%).
(1)0.64g;
(2)0.8g;
(3)0.49%
题目分析:(1)根据质量守恒定律可以知道溶液增加的质量即为样品中二氧化硫的质量,所以被吸收的二氧化硫的质量为:0.64g;
(2)设发生反应的氢氧化钠的质量为x
2NaOH+SO2═Na2SO3+H2O
80 64
x 0.64g

解得:x=0.8g
(3)空气中SO2的质量分数=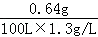 ×100%=0.49%
×100%=0.49%
答:(2)发生反应的NaOH的质量为0.8g;
(3)空气中SO2的质量分数为0.49%