问题
填空题
(10分)某温度下0.1 mol·L-1Na2CO3溶液中,c(Na+)/c(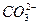 )=20/9>2,其原因是(用离子方程式表示,下同)_________。现向Na2CO3溶液中通入一定量的CO2后,c(Na+)/c(
)=20/9>2,其原因是(用离子方程式表示,下同)_________。现向Na2CO3溶液中通入一定量的CO2后,c(Na+)/c(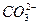 )=5/2>20/9,其原因是_________,此时c(
)=5/2>20/9,其原因是_________,此时c(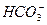 )=_________。
)=_________。
答案
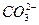 +H2O
+H2O
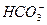 +OH-
+OH- 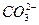 +CO2+H2O====
+CO2+H2O====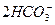 0.04 mol·L-1
0.04 mol·L-1
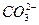 发生水解:
发生水解: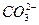 +H2O
+H2O
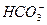 +OH-,导致c(
+OH-,导致c(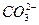 )减少。通入CO2后,发生
)减少。通入CO2后,发生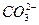 +CO2+H2O====
+CO2+H2O====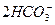 ,导致c(
,导致c(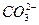 )较大程度地减少。因c(Na+)="0.2" mol·L-1,由c(Na+)/c(
)较大程度地减少。因c(Na+)="0.2" mol·L-1,由c(Na+)/c(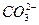 )=5/2得溶液中c(
)=5/2得溶液中c(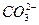 )="0.08" mol·L-1,说明反应消耗的c(
)="0.08" mol·L-1,说明反应消耗的c(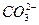 )="0.02" mol·L-1,由
)="0.02" mol·L-1,由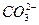 +CO2+H2O====
+CO2+H2O====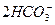 得c(
得c(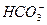 )=0.04 mol·L-1。
)=0.04 mol·L-1。
