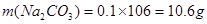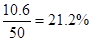甲乙丙三个实验小组分别进行“Na2CO3和NaOH混合物中Na2CO3含量测定”的实验:
(1)甲组的实验方案是:将50克的混合物溶解在水中配成溶液,滴加10%稀盐酸,观察到现象: 。根据消耗盐酸溶液的质量来测定碳酸钠的含量。你认为这个方案是否正确,理由是_______ 。
(2)乙组同学的方案是:根据沉淀的质量计算得出碳酸钠的含量,

乙经正确计算,得出碳酸钠的含量偏大,原因可能是 ,溶液M中的溶质(用化学式表示)是 。
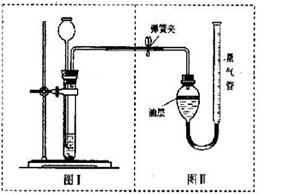
(3)丙组的实验方案是:将50克样品与足量的稀盐酸反应,用下图装置测定产生的CO2气体的体积,通过计算得出样品中Na2CO3的质量。请分析装置中油层的作用是____ _ ____。现收集到0.1摩尔CO2气体,求原混合物中Na2CO3的质量百分数是多少?(精确到0.1%)。(根据化学方程式,写出计算过程)
(1)(1)过一会儿产生气泡 (1分)、正确,因为碳酸钠和氢氧化钠都会消耗盐酸 (1分)(2)洗涤不充分或没有完全干燥(1分), (1分)氯化钙、(1分)氯化钠和(1分)氢氧化钠(3)防止二氧化碳溶解在水中或和水反应 ; 21.2%
题目分析:(1)(1)甲组的实验方案是:将50克的混合物溶解在水中配成溶液,滴加10%稀盐酸,观察到现象是过一会儿产生气泡 该方案是正确,理由是碳酸钠和氢氧化钠都会消耗盐酸 ;(2)乙组同学的方案是:根据沉淀的质量计算得出碳酸钠的含量乙经正确计算,得出碳酸钠的含量偏大,是因为在操作过程中溶质偏多或溶剂偏少引起的,故原因可能是洗涤不充分或没有完全干燥;溶液M中的溶质由过量的氯化钙、生成的氯化钠和没有参加反应的氢氧化钠;(3)(3)丙组的实验方案是,装置中油层的作用是防止二氧化碳溶解在水中或和水反应
设碳酸钠的物质的量为Xmol
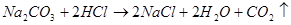 (1分)
(1分)
1 1 (1分)
Xmol 0.1mol
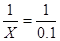
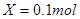 (1分)
(1分)