问题
填空题
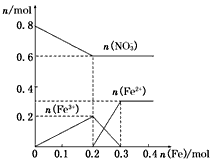
向含有0.8mol的稀硝酸中慢慢加入22.4g的铁粉,假设反应分为两个阶段。
第一阶段为:Fe+4HNO3(稀) ==Fe(NO3)3+NO↑+2H2O
第二阶段为:2Fe(NO3)3+Fe==3Fe(NO3)2
(1)写出第一阶段发生反应的离子方程式: _________________________
(2)在图中画出溶液中Fe2+、Fe3+、NO的物质的量随加入铁粉的物质的量变化的关系图象(横坐标为加入铁粉的物质的量,纵坐标是溶液中离子的物质的量)。
答案
(1)Fe+4H++NO3-==Fe3++NO↑+2H2O
(2)