某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析:
(1).该反应的化学方程式为______.
(2).反应开始至2min,用Z表示的平均反应速率为______.
(3).下列叙述能说明上述反应达到平衡状态的是______(填序号)
A.X、Y、Z的物质的量之比为3:1:2
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol X,同时生成2mol Z
D.混合气体的总质量不随时间的变化而变化
E.混合气体的总物质的量不随时间的变化而变化.
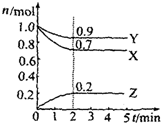
(1)由图象可以看出X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,
化学反应中各物质的物质的量变化量与化学计量数之比呈正比,
则有Y:X:Z=(1.0mol-0.9mol):(1.0mol-0.7mol):0.2mol=1:3:2,则反应的化学方程式为3X+Y

2Z,故答案为:3X+Y

2Z;
(2)反应开始至2min,用Z表示的平均反应速率为v=
=△c △t
=0.05 mol.L-1.min-1,故答案为:0.05 mol.L-1.min-1;0.2mol 2L 2min
(3)A.X、Y、Z的物质的量之比与反应起始时的物质的量和平衡时转化的程度有关,不能说明上述反应达到平衡状态,故A错误;
B.反应前后气体的计量数之和不相等,混合气体的压强不随时间的变化而变化,说明上述反应达到平衡状态,故B正确;
C.无论反应是否平衡,单位时间内每消耗3molX,同时生成2molZ,故C错误;
D.反应遵循质量守恒定律,无论是否平衡,混合气体的总质量不随时间的变化而变化,不能说明上述反应达到平衡状态,,故D错误;
E.化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,混合气体的总物质的量不随时间的变化而变化,可以说明上述反应达到平衡状态,故E正确.
故答案为:B、E.
