(16分)运用化学反应原理研究NH3的性质具有重要意义。请回答下列问题:
(1)已知:①4NH3(g)+3O2(g)===2N2(g)+6H2O(g) 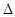 H=-1266.8kJ·mol-1
H=-1266.8kJ·mol-1
②N2(g)+O2(g)===2NO(g) 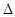 H=180.5kJ·mol-1
H=180.5kJ·mol-1
写出氨高温催化氧化的热化学方程式 。
(2)氨气、空气可以构成燃料电池,其电池反应原理为4NH3+3O2===2N2+6H2O。则原电解质溶液显 (填“酸性”、“中性”或“碱性”),负极的电极反应式为 。
(3)合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
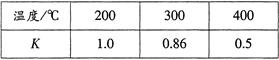
①由上表数据可知该反应为放热反应,理由是 ;
②理论上,为了增大平衡时H2的转化率,可采取的措施是 (填字母序号);
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
③400oC时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol·L-1、2mol·L-1、1mol·L-1时,此时刻该反应的v正(N2) v逆(N2)(填“>”、“<”或“=”)。
(4)①25oC时,将amol·L-1的氨水与0.1mol·L-1的盐酸等体积混合。当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb= ;
②向25mL0.10mol·L-1的盐酸中滴加氨水至过量,该过程中离子浓度大小关系一定不正确的是 (填字母序号)。
a.c(Cl-)>c(H+)>c(NH4+)>c(OH-) b.c(C1-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(Cl-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(Cl-)
(1)4NH3(g)+5O2(g)===4NO(g)+6H2O(g) 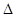 H=-905.8kJ·mol-1。
H=-905.8kJ·mol-1。
(2)碱性,2NH3+6OH-—6e-===N2+6H2O。
(3)①随着温度的升高,平衡常数减小;②ad ;③<。
(4)①10−8/a-0.1;②d。
题目分析:(1)已知:①4NH3(g)+3O2(g)===2N2(g)+6H2O(g) 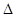 H=-1266.8kJ·mol-1,
H=-1266.8kJ·mol-1,
②N2(g)+O2(g)===2NO(g) 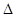 H=180.5kJ·mol-1,根据盖斯定律:①+②×2得氨高温催化氧化的热化学方程式为4NH3(g)+5O2(g)===4NO(g)+6H2O(g)
H=180.5kJ·mol-1,根据盖斯定律:①+②×2得氨高温催化氧化的热化学方程式为4NH3(g)+5O2(g)===4NO(g)+6H2O(g) 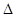 H=-905.8kJ·mol-1。(2)氨气、空气可以构成燃料电池,其电池反应原理为4NH3+3O2===2N2+6H2O。为减少氨气的溶解损失,则原电解质溶液显碱性,负极的电极反应式为2NH3+6OH-—6e-===N2+6H2O。(3)①由上表数据可知该反应为放热反应,理由是随着温度的升高,平衡常数减小;②合成氨的反应正向为气体体积减小的放热反应,为了增大平衡时H2的转化率,需使平衡正向移动,a.增大压强,平衡正向移动,正确;b.使用合适的催化剂,平衡不移动,错误; c.升高温度,平衡逆向移动,错误;d.及时分离出产物中的NH3,平衡正向移动,正确,选ad ;③利用Q与K的关系判断。400oC时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol·L-1、2mol·L-1、1mol·L-1时,此时刻Q=4.5,K=0.5,Q>K,反应逆向进行,v正(N2)<v逆(N2)。 (4)①根据电荷守恒有c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于c(NH4+)=c(Cl-),故c(H+)=c(OH-),溶液呈中性,故溶液中c(OH-)=10-7mol/L,溶液中c(NH4+)=c(Cl-)=1/2×0.1mol•L-1=0.05mol•L-1,故混合后溶液中c(NH3.H2O)=1/2amol•L-1-0.05mol•L-1=(0.5a-0.05)mol/L,NH3•H2O的电离常数Kb=10−7×0.05/0.5a-0.05=10−8/a-0.1;②盐酸与氨水反应可能出现三种情况:Ⅰ、盐酸过量,体系为NH4Cl和HCl溶液:a盐酸过量的较多(即开始向酸液中滴加氨水)时,c(Cl-)>c(H+)>c(NH4+)>c(OH-);b盐酸稍稍过量时:c(Cl-)>c(NH4+)>c(H+)>c(OH-);Ⅱ、两者恰好完反应,体系为NH4Cl溶液:c(Cl-)>c(NH4+)>c(H+)>c(OH-);Ⅲ、氨水过量:体系为NH4Cl溶液和NH3.H2O:a氨水稍过量时,溶液呈中性:c (Cl-)=c(NH4+)>c(H+)=c(OH-);b氨水稍稍过量时,溶液呈中性以前:c(NH4+)>c(Cl-)>c(H+)>c(OH-);c氨水过量较多时,溶液呈碱性:c(NH4+)>c(Cl-)>c(OH-)>c(H+)或c(NH4+)>c(OH-)>c(Cl-)>c(H+),综上所述,不可能出现c(OH-)>c(NH4+)>c(H+)>c(Cl-),选d。
H=-905.8kJ·mol-1。(2)氨气、空气可以构成燃料电池,其电池反应原理为4NH3+3O2===2N2+6H2O。为减少氨气的溶解损失,则原电解质溶液显碱性,负极的电极反应式为2NH3+6OH-—6e-===N2+6H2O。(3)①由上表数据可知该反应为放热反应,理由是随着温度的升高,平衡常数减小;②合成氨的反应正向为气体体积减小的放热反应,为了增大平衡时H2的转化率,需使平衡正向移动,a.增大压强,平衡正向移动,正确;b.使用合适的催化剂,平衡不移动,错误; c.升高温度,平衡逆向移动,错误;d.及时分离出产物中的NH3,平衡正向移动,正确,选ad ;③利用Q与K的关系判断。400oC时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol·L-1、2mol·L-1、1mol·L-1时,此时刻Q=4.5,K=0.5,Q>K,反应逆向进行,v正(N2)<v逆(N2)。 (4)①根据电荷守恒有c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于c(NH4+)=c(Cl-),故c(H+)=c(OH-),溶液呈中性,故溶液中c(OH-)=10-7mol/L,溶液中c(NH4+)=c(Cl-)=1/2×0.1mol•L-1=0.05mol•L-1,故混合后溶液中c(NH3.H2O)=1/2amol•L-1-0.05mol•L-1=(0.5a-0.05)mol/L,NH3•H2O的电离常数Kb=10−7×0.05/0.5a-0.05=10−8/a-0.1;②盐酸与氨水反应可能出现三种情况:Ⅰ、盐酸过量,体系为NH4Cl和HCl溶液:a盐酸过量的较多(即开始向酸液中滴加氨水)时,c(Cl-)>c(H+)>c(NH4+)>c(OH-);b盐酸稍稍过量时:c(Cl-)>c(NH4+)>c(H+)>c(OH-);Ⅱ、两者恰好完反应,体系为NH4Cl溶液:c(Cl-)>c(NH4+)>c(H+)>c(OH-);Ⅲ、氨水过量:体系为NH4Cl溶液和NH3.H2O:a氨水稍过量时,溶液呈中性:c (Cl-)=c(NH4+)>c(H+)=c(OH-);b氨水稍稍过量时,溶液呈中性以前:c(NH4+)>c(Cl-)>c(H+)>c(OH-);c氨水过量较多时,溶液呈碱性:c(NH4+)>c(Cl-)>c(OH-)>c(H+)或c(NH4+)>c(OH-)>c(Cl-)>c(H+),综上所述,不可能出现c(OH-)>c(NH4+)>c(H+)>c(Cl-),选d。