用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g/mol)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是________>__________>__________。
(2)Na2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为_______________。
(3)工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3-+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O。
①写出第二步反应的离子方程式______________。
②工业生产时需在反应物中加少量Cl-,其作用是________________。
③生产中会发生副反应ClO3-+Cl-+H+-Cl2↑+H2O(未配平),若测得反应后的混合气体中Cl2的体积分数为3/73,则起始投料时CH3OH与NaClO3的物质的量之比为____________。
(4)已知二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。ClO2也可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐。工业上用稍潮湿的KClO3和草酸在60℃时反应制得。某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:
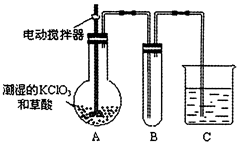
①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置___________;
②C中应装的试剂为____________。C中发生反应的化学方程式为:________________。
(1)ClO2; Cl2 Na2FeO4 (2) 4FeO42-+10 H2O=4Fe(OH)3+8OH-+3O2↑(3) ①CH3OH+3Cl2+H2O=6Cl-+ CO2+6H+.②催化剂③1:6.1(4)①(冰水)冷凝②NaOH溶液 2ClO2+2NaOH=NaClO2+NaClO3+H2O
题目分析:(1) ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率分别是ClO2: 67.5g÷5mol=" 13.5g/mol;" Na2FeO4: 166g÷3mol=55.33g/mol;Cl2:71g/ 2mol=35.5g/mol.所以三种消毒杀菌剂的消毒效率由大到小的顺序是ClO2> Cl2>Na2FeO4. (2) 根据题意可得Na2FeO4把H2O氧化为O2,氧气杀菌消毒,它本身被还原为Fe3+。Fe3+水解产生Fe(OH)3胶体吸附水中的悬浮物质。从而净化了水。该反应的离子方程式为:4FeO42-+10 H2O=4Fe(OH)3+8OH-+3O2↑。(3)①第二步反应的离子方程式为:CH3OH+3Cl2+H2O=6Cl-+ CO2+6H+。②由①中的两个反应方程式可以看出若转移相同的电子,Cl-的消耗与产生量相等。之所以在工业生产时要在反应物中加少量Cl-,是因为Cl-起作催化剂作用。③将第一步与第二步的方程式叠加可得总方程式:6ClO3-+CH3OH+6H+=CO2↑+6ClO2↑+5H2O。将副反应ClO3-+Cl-+H+-Cl2↑+H2O配平可得:ClO3-+5Cl-+6H+=3Cl2↑+3H2O若测得反应后的混合气体中Cl2的体积分数为3/73,假设气体的总物质的量为73mol,则Cl2为3mol;CO2和ClO2总物质的量为70mol。产生3mol的Cl2消耗NaClO3的物质的量1mol;根据方程式6ClO3-+CH3OH+6H+=CO2↑+6ClO2↑+5H2O可知产生CO2和ClO2总物质的量为70mol消耗CH3OH的物质的量为10mol;消耗 NaClO3的物质的量为60mol。所以共消耗CH3OH的物质的量为10mol;消耗 NaClO3的物质的量为60mol+3mol=61mol。因此起始投料时CH3OH与NaClO3的物质的量之比为10:61=1:6.1.(4) ①因为ClO2的沸点低,容易挥发,所以B部分还应补充的装置是冷凝装置。可以用冰水进行降温。②C为尾气吸收装置,由于ClO2能与碱发生反应,所以通常用NaOH溶液来吸收。反应的方程式为:2ClO2+2NaOH=NaClO2+NaClO3+H2O。2的制法、性质及涉及的化学反应原理。主要包括氧化还原反应的化学方程式、离子方程式的配平、书写、实验装置的选择、应用和有关计算的知识。
