(17分)化学反应原理在科研和生产中有广泛应用。
(1)一定条件下,模拟某矿石形成的反应aW+bQ→cN+dP+eR得到两个图像。
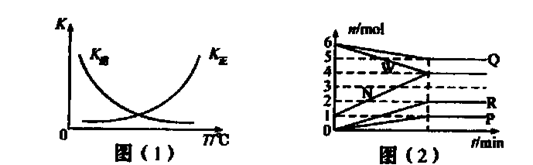
①该反应的△H 0(填“>”、“=”或“<”)。
②某温度下,平衡常数表达式为K =c2(X),则由图(2)判定X代表的物质为____。
(2)将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略
2G(g)。忽略
固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
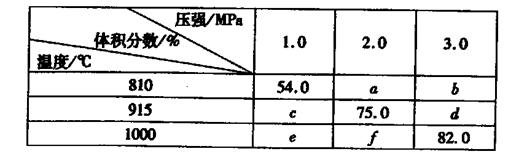
则K(915℃)与K(810℃)的关系为K(915℃)____K(810℃)(填“大于”、“等于”或“小于”),a、b、f三者的大小关系为 ,1000℃、3.0 MPa时E的转化率为____。(3)25℃时,H2CO3 HCO3-+H+的电离常数Ka=4×10—7 mo1·L-1,则该温度下,NaHCO3的水解常数Kh= ,请用适当的试管实验证明Na2CO3溶液中存在CO32-+H2O
HCO3-+H+的电离常数Ka=4×10—7 mo1·L-1,则该温度下,NaHCO3的水解常数Kh= ,请用适当的试管实验证明Na2CO3溶液中存在CO32-+H2O  HCO3-+OH-的事实 。
HCO3-+OH-的事实 。
(1)①>。②R。(2)大于;f>a>b;69.5%。(3)2.5×10—8,取少量碳酸钠溶液置于试管中,滴加氯化钡溶液有白色沉淀生成,证明含有碳酸根;另取少量碳酸钠溶液置于试管中,滴加酚酞溶液变红,证明有氢氧根生成。
题目分析:(1)①根据图(1)知,该反应的K正随温度的升高而增大,则该反应正向为吸热反应,△H>0。②根据图(2)知,该反应的化学方程式为2W+Q→3N+P+2R;某温度下,平衡常数表达式为K =c2(X),根据平衡常数表达式的书写原则:固体或纯液体不写入平衡常数表达式,则由图(2)判定X代表的物质为R。
(2)反应:E(g)+F(s) 2G(g)正向为气体体积减小的反应,加压,平衡逆向移动,G的体积分数(%)减小,结合题给数据分析,横行为压强对平衡影响的数据,即54.0>a>b;c>75.0>d;e>f>82.0;可得a、b、f三者的大小关系为f>a>b。根据上述分析知,e>c>54.0,表中数据纵行为温度对平衡的影响,升温,G的体积分数(%)增大,平衡正向移动,则该反应正向为吸热反应,则K(915℃)与K(810℃)的关系为K(915℃)大于K(810℃)。根据题给数据知,1000℃、3.0 MPa时G的体积分数(%)为82.0,根据反应:E(g)+F(s)
2G(g)正向为气体体积减小的反应,加压,平衡逆向移动,G的体积分数(%)减小,结合题给数据分析,横行为压强对平衡影响的数据,即54.0>a>b;c>75.0>d;e>f>82.0;可得a、b、f三者的大小关系为f>a>b。根据上述分析知,e>c>54.0,表中数据纵行为温度对平衡的影响,升温,G的体积分数(%)增大,平衡正向移动,则该反应正向为吸热反应,则K(915℃)与K(810℃)的关系为K(915℃)大于K(810℃)。根据题给数据知,1000℃、3.0 MPa时G的体积分数(%)为82.0,根据反应:E(g)+F(s) 2G(g)利用三行式计算,设起始加入的E物质的量为1mol,转化的为x。
2G(g)利用三行式计算,设起始加入的E物质的量为1mol,转化的为x。
E(g)+F(s) 2G(g)
2G(g)
起始(mol):1 足量 0
转化(mol):x 2x
平衡(mol):1—x 2x
则2x/1+x=82.0%,解得x=0.695,E的转化率为69.5%。
(3)25℃时,H2CO3电离常数Ka=c(HCO3—)c(H+)/c(H2CO3),NaHCO3的水解常数Kh=c(H2CO3)c(OH-)/c(HCO3—),则Ka·Kh=Kw,Kh=Kw/Ka=10—14/4×10—7=2.5×10—8,证明Na2CO3溶液中存在
 CO32-+H2O HCO3-+OH-的事实为取少量碳酸钠溶液置于试管中,滴加氯化钡溶液有白色沉淀生成,证明含有碳酸根;另取少量碳酸钠溶液置于试管中,滴加酚酞溶液变红,证明有氢氧根生成。
CO32-+H2O HCO3-+OH-的事实为取少量碳酸钠溶液置于试管中,滴加氯化钡溶液有白色沉淀生成,证明含有碳酸根;另取少量碳酸钠溶液置于试管中,滴加酚酞溶液变红,证明有氢氧根生成。
