问题
选择题
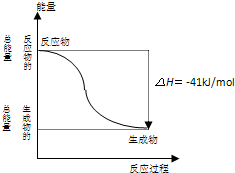
反应:CO(g)+H2O (g)=CO2(g)+H2(g) 的能量变化如图所示,有关该反应的说法正确的是( )
A.该反应为吸热反应
B.1molCO2(g)和1molH2(g)反应生成1molCO(g)和1molH2O(g)要放出41kJ热量
C.反应的热化学方程式是:CO(g)+H2O(g)=CO2(g)+H2(g)△H=+41kJ/mol
D.CO(g)与H2O(g)所具有的总能量大于CO2(g)与H2(g)所具有的总能量
答案
A、从图示可知,反应物能量高生成物能量低,所以该反应为放热反应,从反应热为“-”也可知此反应为放热反应,故A错误;
B、从图示可知,正反应为放热反应,则逆反应为吸热反应,故B错误;
C、从图示可知,正反应为放热反应,正确的热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol,故C错误;
D、从图示可知,反应物的能量高,生成物能量低,故D正确.
故选D.
