合成氨尿素工业生产过程中涉及到的物质转化过程如下图所示.
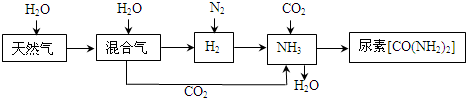
(1)天然气在高温、催化剂作用下与水蒸气反应生成H2和CO的化学方程式为______.
(2)在合成氨生产中,将生成的氨及时从反应后的气体中分离出来.运用化学平衡的知识分析这样做的是否有利于氨的合成,说明理由:______.
(3)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数.
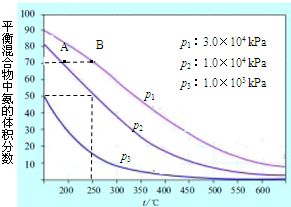
①若分别用υA(NH3)和υB(NH3) 表示从反应开始至达平衡状态A、B时的化学反应速率,则υA(NH3)______υB(NH3)(填“>”、“<”或“=”).
②在相同温度、当压强由p1变为p3时,合成氨反应的化学平衡常数______.(填“变大”、“变小”或“不变”).
③在250℃、1.0×104kPa下,H2的转化率为______%(计算结果保留小数点后1位).
(4)NH3(g) 与CO2(g) 经过两步反应生成尿素,两步反应的能量变化示意图如下:
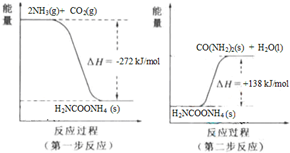
NH3(g) 与CO2(g) 反应生成尿素的热化学方程式为______.
(5)运输氨时,不能使用铜及其合金制造的管道阀门.因为,在潮湿的环境中,金属铜在有NH3存在时能被空气中的O2氧化,生成Cu(NH3)42+,该反应的离子方程式为______.
(1)甲烷与水蒸气反应生成一氧化碳和氢气,该反应为CH4+H2O
CO+3H2,故答案为:CH4+H2O 高温 .
CO+3H2; 高温 .
(2)减少生成物的浓度,化学平衡正向移动,所以移走氨气,减小生成物浓度,平衡右移,有利于氨生成,故答案为:移走氨气,减小生成物浓度,平衡右移,有利于氨生成;
(3)①温度越大,压强越大,反应速率越大,由图可知,B对应的温度、压强大,则反应速率大,故答案为:<;
②化学平衡常数只与温度有关,显然温度不变,则化学平衡常数K不变,故答案为:不变;
③在250℃、1.0×104kPa下,氨气的体积分数为50%,则
N2+3H2⇌2NH3
开始 1 3 0
转化 x 3x 2x
平衡 1-x 3-3x 2x
所以
=50%,解得x=2x 4-2x
,则氢气的转化率为2 3
×100%=66.7%,故答案为:66.7;3× 2 3 3
(4)由图示可知,两步反应的完成的热效应与一步完成的热效应是相同的,将两个反应相加可得2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-134 kJ/mol,
故答案为:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-134 kJ/mol;
(5)铜在有NH3存在时能被空气中的O2氧化,生成Cu(NH3)42+,该离子反应为2Cu+8NH3+O2+2H2O═2Cu(NH3)42++4OH-,故答案为:2Cu+8NH3+O2+2H2O═2Cu(NH3)42++4OH-.
