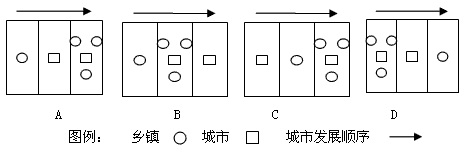
问题
选择题
一定条件下,在反应2SO2(g)+O2(g)⇌2SO3(g)平衡体系中:n(SO2)=2.0mol/L,n(O2)=0.8mol/L,n(SO3)=2.4mol/L,则SO2的起始浓度的范围为( )
A.0.4~2.0mol/L
B.0.4~4.4mol/L
C.0~4mol/L
D.无法确定
答案
若向正反应进行建立平衡,二氧化硫的起始浓度最大,三氧化硫的浓度变化量为△n(SO3)=2.4mol/L,由方程式2SO2(g)+O2(g)⇌2SO3(g)二氧化硫的浓度变化量△n(SO2)=△n(SO3)=2.4mol/L,故二氧化硫的起始浓度极大值为2mol/l+2.4mol/L=4.4mol/L,
若由逆反应开始建立平衡,二氧化硫的起始浓度最小,由方程式2SO2(g)+O2(g)⇌2SO3(g)可知,生成的二氧化硫与氧气的浓度变化量之比为2:1,实际为2mol/L:0.8mol/L=2.5:1,故开始二氧化硫的浓度不为0,由氧气的浓度可知转化生成的二氧化硫浓度为0.8mol/L×2=1.6mol/L,故二氧化硫的起始浓度极小值为2mol/L-1.6mol/L=0.4mol/L,
故二氧化硫的起始浓度介于0.4~4.4mol/L之间,
故选B.