X、Y、Z、W均为10电子的分子或离子。X有5个原子核。通常状况下,W为无色液体。它们之间转化关系如图所示,请回答:
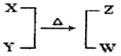
(1)工业上每制取1molZ要放出46.2 kJ的热量,写出该反应的热化学方程式: 。
(2)工业制取Z的化学平衡常数K与T的关系如下表:
| T/K | 298 | 398 | 498 | …… |
| K/(mol·L—1)—2 | 4.1×106 | K1 | K2 | …… |
请完成下列问题:
①试比较K1、K2的大小,K1 K2(填写“>”“=”或“<”)
②恒温固定体积的容器中,下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。
A.容器内各物质的浓度之比为化学计量数比
B.混合气体密度保持不变
C.容器内压强保持不变
D.混合气体相对分子质量保持不变
(3)某化学小组同学模拟工业生产制取HNO3,设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球。
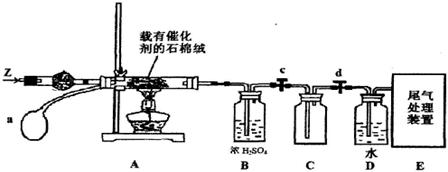
①A中发生反应的化学方程式是 。
②B中浓H2SO4的作用是 。
(4)写出D装置中反应的化学方程式 。
(5)a中通入空气的作用 。
(1)N2(g)+3H2 2NH3(g) ΔH=—92.4KJ/mol(3分)
2NH3(g) ΔH=—92.4KJ/mol(3分)
(2) ① > ②CD
(3)①4NH+5O2 4NO+6H2O ②吸收水和多余的氨气
4NO+6H2O ②吸收水和多余的氨气
(4)3 NO2+H2O=2HNO3+NO或4NO2+O2+2H2O=4HNO3
(5)氧化NH3和NO
题目分析:(1)5个原子核的10电子的微粒一般为CH4、NH4+NH4+,W为无色液体,10电子的无色液体为H2O,所以猜想该反应为NH4+与OH-制取NH3的反应,X为NH4+,Y为OH-,Z为NH3。工业制取氨气的化学反应为N2+3H2 2NH3,每制取1molNH3要放出46.2kJ的热量,所以该反应的热化学方程式为N2(g)+3H2
2NH3,每制取1molNH3要放出46.2kJ的热量,所以该反应的热化学方程式为N2(g)+3H2 2NH3(g) ΔH=—92.4KJ/mol
2NH3(g) ΔH=—92.4KJ/mol
(2)①制取氨气的反应为放热反应,升高温度有利于平衡逆向移动,平衡常数减小,所以K1>K2
②A、达平衡时容器内各物质的浓度之比不一定为化学计量数比,错误;B、恒容的容器中,气体的密度始终不变,错误;C、随着反应的进行,气体的压强逐渐减小,达平衡时不再变化,正确;D、随着反应的进行,气体的物质的量逐渐减小,气体的相对分子质量逐渐增大,达平衡时不再变化,正确,答案选CD。
(3)①A中发生反应是氨气的催化氧化,其化学方程式是4NH+5O2 4NO+6H2O
4NO+6H2O
②浓H2SO4具有吸水性,也可以和氨气反应,所以B中浓H2SO4的作用是吸收水和多余的氨气
(4)由于空气的不断鼓入,二氧化氮与水、氧气完全反应生成硝酸,化学方程式为4NO2+O2+2H2O=4HNO3或3 NO2+H2O=2HNO3+NO
(5)a中通入空气的作用就是不断氧化NH3和NO