问题
问答题
已知五种短周期元素在周期表中的相对位置如下表所示:
| a | |||||
| b | |||||
| c | d | e |
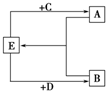
(2)已知A、B、C、D、E五种化合物均由上述元素中的几种组成.它们之间的转换关系如图所示,且A、B、E三种物质含有相同的一种金属元素,C和D分别是常见的强酸和强碱,则:
①A、B、E所含的该金属元素的原子结构示意图为______;
②若将D逐滴滴入A的溶液中至过量,反应过程中的离子方程式依次为______.
答案
(1)根据a、b、c、d、e在元素周期表中的位置,可知五种元素分别为氢、氧、钠、铝、硫,离子的核外电子层数越多,则离子半径最大,所以离子半径最大的为S2-,
故答案为:S;
(2)C和D分别是常见的强酸和强碱,可知E既能与酸反应,又能与碱反应,则E应为Al(OH)3,C为H2SO4,D为NaOH,
①A、B、E所含的该金属元素为Al,则Al原子结构示意图为
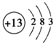
,故答案为:
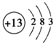
;
②在硫酸铝中逐滴加入NaOH,首先发生:Al3++3OH-═Al(OH)3↓,
Al(OH)3具有两性,能继续与NaOH反应生成-═[Al(OH)4]-,
反应的离子方程式为Al(OH)3+OH-═[Al(OH)4]-,
故答案为:Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═[Al(OH)4]-.
