(16分)已知2A(g)+B(g)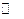 2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
⑴比较a ▲ b(填“>”“=”或“<”)。
⑵下表为不同温度下该反应的平衡常数。由此可推知,表中T1 ▲ T2(填“>” “=”或“<”)。
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
⑶ 在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是 ▲ 。
A. 4molA和2molB B. 4molA、2molB和2molC
C. 4molA和4molB D. 6molA和4molB
⑷为使该反应的反应速率增大,且平衡向正反应方向移动的是 ▲ 。
A. 及时分离出C气体 B. 适当升高温度
C. 增大B的浓度 D. 选择高效催化剂
⑸ 若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA和1molB,500℃时充分反应达平衡后,放出热量为d kJ,则d ▲ b(填“>”“=”或“<”),理由是 ▲ 。
⑹ 在一定温度下,向一个容积可变的容器中,通入3molA和2molB及固体催化剂,使之反应,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量 ▲ (填“不变”“变大”“变小”或“无法确定”)。
(16分)
⑴ a>b(2分) ⑵<(1分) =(1分) a=b+c(2分)
⑶ D (2分) ⑷ C (2分)
⑸>(2分) 由于反应过程中恒压容器中压强大于恒容容器,所以转化率更大,放热更多(2分)
⑹不变(2分)
