在一定温度下,向一个容积可变的恒压容器中,通入3 mol SO2和2 mol O2及固体催化剂,使之反应:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol SO2、3 mol O2、2 mol SO3(g),下列说法正确的是
2SO3(g) ΔH=-196.6 kJ·mol-1,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol SO2、3 mol O2、2 mol SO3(g),下列说法正确的是
A.第一次实验平衡时反应放出的热量为98.3kJ
B.第一次实验平衡时SO2的转化率比第二次实验平衡时SO2的转化率大
C.第二次实验达平衡时SO3的体积分数大于2/9
D.两次实验平衡时,SO3的浓度相等
AD
2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
起始 3 mol 2 mol 0
变化 2x x 2x
平衡 3—2x 2—x 2x
根据阿伏加德罗定律的推论:同温同体积,压强之比=物质的量之比
得: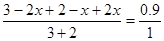 ;x=0.5
;x=0.5
根据热化学方程式可求得第一次实验平衡时反应放出的热量为98.3kJ,A对
若保持同一反应温度,在相同容器中,将起始物质的量改为4 mol SO2、3 mol O2、2 mol SO3(g)
则:在恒温恒压条件下:
2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
第一组 3 mol 2 mol 0
第二组 4 mol 3 mol 2 mol等效于
6 mol SO2 4 mol O2 0 mol SO3(g)
即第一次实验与第二次实验互为等效平衡,所以两次平衡转化率相同,SO3的体积分数相同,浓度相等。
