问题
选择题
下列说法正确的是
A.0.01 mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,所得溶液中c(H+)=c(OH-)
B.氯水中离子浓度大小关系是:c(H+)>c(Cl-)>c(OH-)>c(ClO-)
C.25℃时,将pH=a的醋酸溶液稀释10倍后,溶液的pH=b,则a>b
D.25℃时,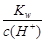 =0.1 mol·L-1的溶液中,Na+、CO32-、Cl-一定能大量共存
=0.1 mol·L-1的溶液中,Na+、CO32-、Cl-一定能大量共存
答案
答案:D
A错,0.01 mol·L-1氨水与0.01 mol·L-1盐酸等体积混合两溶液恰好完全反应生成氯化铵,由于铵根离子的水解溶液显酸性,即所得溶液中c(H+)>c(OH-);
B错,氯水中离子浓度大小关系是:c(H+)>c(Cl-)>c(ClO-)>c(OH-);
C错,25℃时,将pH=a的醋酸溶液稀释10倍后,溶液中氢离子浓度减小,即pH增大,所以b>a
D正确,25℃时,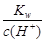 =
=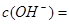 0.1 mol·L-1的溶液为碱性溶液,在碱性溶液中Na+、CO32-、Cl-之间不反应,一定能大量共存。
0.1 mol·L-1的溶液为碱性溶液,在碱性溶液中Na+、CO32-、Cl-之间不反应,一定能大量共存。
