某二元酸(H2A)按下式发生电离:H2A=H++HA-;HA-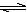 H++A2-。现有下列四种溶液:
H++A2-。现有下列四种溶液:
① 0.01mol・L1的H2A溶液
② 0.01mol・L1的NaHA溶液
③ 0.02mol・L1的HCl溶液与0.04mol・L1的NaHA溶液等体积混合
④ 0.02mol・L1的NaOH溶液与0.02mol・L1的NaHA溶液等体积混合
下列关于上述四种溶液的说法正确的是( )
A.溶液②中存在水解平衡:HA―+H2O  H2A+OH―
H2A+OH―
B.溶液③中有:c(HA-)+2c(A2-)=c(Na+)
C.溶液④中有:c(OH-)=c(H+)+c(HA-)
D.四种溶液中c (HA-)浓度大小:③>①>②>④
CD
题目分析:二元酸H2A在水溶液中发生电离:H2A=H++HA-,HA- H++A2-,这说明是二元酸的第一步电离是完全的,而第二步电离存在电离平衡。因此HA-离子只存在电离平衡,不存在水解平衡,溶液显酸性,选项A不正确;B不正确,不符合物料守恒,应该是c(HA-)+c(A2-)=c(Na+);④中恰好反应生成Na2A,水解溶液显碱性,正确,符合质子守恒;③中盐酸的存在抑制HA-的电离,c (HA-)浓度最大,而④中最小。①第一步电离出的氢离子抑制第二步的电离,所以c (HA-)浓度大于②中,则选项D正确,答案选CD。
H++A2-,这说明是二元酸的第一步电离是完全的,而第二步电离存在电离平衡。因此HA-离子只存在电离平衡,不存在水解平衡,溶液显酸性,选项A不正确;B不正确,不符合物料守恒,应该是c(HA-)+c(A2-)=c(Na+);④中恰好反应生成Na2A,水解溶液显碱性,正确,符合质子守恒;③中盐酸的存在抑制HA-的电离,c (HA-)浓度最大,而④中最小。①第一步电离出的氢离子抑制第二步的电离,所以c (HA-)浓度大于②中,则选项D正确,答案选CD。
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,综合性强,在注重对学生基础知识巩固与训练的同时,侧重对学生能力的培养与解题方法的指导和训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。该题的关键是利用好几种守恒关系,即电荷守恒、物料守恒以及质子守恒,其次还需要注意酸式盐的电离程度和水解程度的相对大小。
