(6分)在密闭容器中进行如下反应:mA(g)+nB(g)  pC(g),反应经5 min达到平衡,测得此时A的浓度减小了a mol·L-1,而C的浓度增加了2/3a mol·L-1,又知平均反应速率v(C)=2v(B)。
pC(g),反应经5 min达到平衡,测得此时A的浓度减小了a mol·L-1,而C的浓度增加了2/3a mol·L-1,又知平均反应速率v(C)=2v(B)。
(1)写出上述化学方程式中各物质的计量数:m=________,n=________,p=________
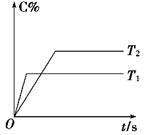
(2)压强一定时,C的百分含量(C%)与温度、时间(T表示温度,t表示时间)的关系如图所示。由此可知,该反应为 (填“吸热”或“放热”)反应。
(3)该反应的平衡常数表示式为 ,升高温度,K值将 (填“增大”、“减小”或“不变”)。
(6分):(1)3 1 2(每空1分) (2)放热(1分)
(3)K=c2(C)/c3(A).c(B) (2分)减小(2分)
(1)平均反应速率v(C)=2v(B),所以B的浓度减少了1/3amol/L。根据变化量之比是相应的化学计量数之比可知,m︰n︰p=3︰1︰2,所以m=3,n=1,p=2。
(2)根据图像可知,T1首先达到平衡状态,所以温度是T1大于T2。温度高,C的百分含量低,说明升高温度平衡向逆反应方向进行,所以正反应是放热反应。
(3)平衡常数是在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以平衡常数的表达式是K=c2(C)/c3(A).c(B);升高温度平衡向逆反应方向进行,,所以平衡常数是减小的。