有一均匀的粒状的镁、铝合金,某学生用如图所示的装置,通过测定合金与酸反应生成氢气的体积及反应前后合金质量的变化,来测定合金中镁、铝的质量分数.试回答下列问题:
(1)实验时应在烧杯中加入______,在球形管中加入______,在广口瓶中加入______.提供试剂:
A、蒸馏水 B、稀硝酸 C、稀硫酸 D、镁、铝合金
(2)实验过程中的部分操作如下:
a、读出量筒内液体的体积 b、向烧杯和广口瓶中加试剂 c、取出球形管 d、向球形管中加入试剂,置于烧杯中.
请将实验过程的先后顺序将它们排列:______.
(3)若合金的质量实验前为m1g,反应后的质量为m2g,量筒中接受的液体的体积为VL,为求出合金中镁铝的质量分数,还缺少的一个数据是______
A、反应前烧杯的试剂的体积 B、反应前烧杯中试剂的浓度
C、实验前广口中试剂瓶的体积 D、实验条件下氢气的密度.
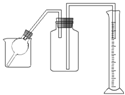
(1)镁、铝排在氢前,都可以与盐酸或稀硫酸反应生成氢气,与硝酸等强氧化性酸反应不能产生氢气,实验时,可将镁、铝合金放在球形管中,稀硫酸放在烧杯中,要测定生成氢气的体积,可以使用排水法,所以在广口瓶中放入水;
故答案为:C,D,A;
(2)进行实验时,为防止生成的氢气散逸造成结果不准确,首先向烧杯和广口瓶中分别加入稀硫酸和蒸馏水,然后再向球形管中加入合金,置于烧杯中,使反应进行,反应完毕,取出球形管,读出读数即可;
故答案为:bdca;
(3)要求合金中镁铝的质量分数,可以根据消耗的合金的质量和生成氢气的质量进行计算,所以知道了氢气的体积,要求氢气的质量,还需要知道氢气的密度;
故选D.

