研究化学反应对人类社会的发展进步有重要意义.
(1)已知:N2(g)+3H2(g)2NH3(g)△H1=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H2=-523.6kJ/mol
H2O(g)=H2O(l)△H3=-44.0kJ/mol
根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应生成氨气,试写出此反应的热化学方程式______.
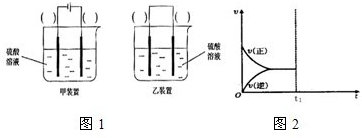
(2)现有反应:Cu+H2SO4═CuSO4+H2,欲通过如图1所示装置实现上述反应,请选择合适的装置在括
号内标出电极材料(填“Cu”或“C”),并且写出C电极上的电极反应式______.
(3)长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率.水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去.则CaSO4 转化为CaCO3的离子方程式为______.
(4)科学研究发现纳米级Cu2O的可作为太阳光分解水的催化剂.一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气,发生反应:2H2O(g)
2H2(g)+O2(g)△H>0,不同时段产生O2的量见下表:光 Cu2O
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
①该条件下上述反应的化学平衡常数K=______;
②若达到平衡后在t1时刻保持温度不变,将容器的体积缩小,请在图2中画出正、逆反应速率随时间变化的关系图.
解(1)已知:①N2(g)+3H2(g)2NH3(g)△H1=-92.4kJ/mol
②2H2(g)+O2(g)=2H2O(g)△H2=-523.6kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
则反应2N2(g)+6H2O(l)=4NH3(g)+3O2(g)等于①×2-3×②-6×③,所以△H=2△H1-3△H2-6△H3=-1650 kJ/mol,
故答案为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=-1650 kJ/mol;
(2)Cu和H2SO4之间的反应是非自发的,需要电解池实现,金属铜作阳极,阴极是导体即可,电解质为硫酸,即:
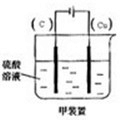
,
C电极为阴极,反应为:2H++2e-→H2↑,故答案为:

;2H++2e-→H2↑;
(3)沉淀向着更难溶的方向转化,CaSO4和碳酸钠反应转化为CaCO3的离子方程式为:CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq),
故答案为:CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq);
(4)①根据表中数据,可以看出反应在60min时达到平衡,则
2H2O(g)
2H2(g)+O2(g)光 Cu2O
初始浓度:0.05 0 0
变化浓度:0.002 0.002 0.001
平衡浓度:0.048 0.002 0.001
则平衡常数K=
=1.7×10-6mol/L,由图可知H2的浓度随时间降低,改变条件瞬间H2浓度不变,所以不保持温度不变,将容器的体积缩小,c2(H2)•c(O2) c2(H2O)
则压强增大,正逆反应速率均增大,平衡向着气体体积减小的方向进行,即向左进行,所以逆反应速率还是大于正反应速率,即

,
故答案为:1.7×10-6mol/L;

.
