问题
填空题
煤直接燃烧的能量利用率较低,为提高其利用率,工业上将煤气化(转变成CO和H2)后再合成乙醇、二甲醚等多种能源。
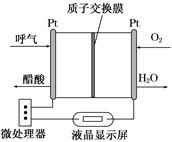
(1)如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流 量侦测与控制的功能,非常适合进行现场酒精检测。该电池的负极反应式为______________________。
(2)煤气化所得气体可用于工业合成二甲醚,其反应如下:
2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。
同时发生副反应:CO(g)+2H2(g) CH3OH(g);CO(g)+H2O(g)CO2(g)+H2(g)。
CH3OH(g);CO(g)+H2O(g)CO2(g)+H2(g)。
在温度为250 ℃、压强为3.0 MPa时,某工厂按投料比V(H2)∶V(CO) =a进行生产,平衡时反应体系中各组分的体积分数如下表:
| 物质 | H2 | CO | CO2 | (CH3)2O | CH3OH(g) | H2O(g) |
| 体积分数 | 0.54 | 0.045 | 0.18 | 0.18 | 0.015 | 0.03 |
①投料比a=________;
②250℃时反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K=________。
CO2(g)+H2(g)的平衡常数K=________。
答案
(1)CH3CH2OH+H2O-4e-=CH3COOH+4H+ (2)①1.9 ②72
(1)根据图示可知负极上发生乙醇氧化为乙酸的反应。 (2)①根据碳原子守恒和氢原子守恒,可得原投料中H2和CO的物质的量之比为(0.54×2+0.18×6+0.015×4+0.03×2)×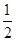 ∶(0.045+0.18+0.18×2+0.015)=1.14∶0.6=1.9,即a=1.9。②计算平衡常数时,体积分数可直接代替物质的量浓度进行计算(同一体系中气体物质的体积分数之比等于物质的量浓度之比),故K=
∶(0.045+0.18+0.18×2+0.015)=1.14∶0.6=1.9,即a=1.9。②计算平衡常数时,体积分数可直接代替物质的量浓度进行计算(同一体系中气体物质的体积分数之比等于物质的量浓度之比),故K=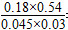 =72。
=72。
