(14分)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号)__________
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化(2)下表所列数据是反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①该反应化学平衡常数表达式K=
②由表中数据判断该反应的△H__________0(填“>”、“=”或“<”);
③某温度下,将2molCO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得C(CO)=0.2mol·L-1,此时的温度为__________
(3)25℃101KPa下,1g液态甲醇完全燃烧生成CO2和液态水时放出热量22.68kJ,表示甲醇燃烧热的热化学方程式为
(4)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,该电池工作时负极电极反应式为 。若反应时消耗16g甲醇所产生的电能电解足量的CuSO4溶液,则将产生标准状况下的O2________升
⑴C、 D;⑵①K=c(CH3OH)/c(CO)·c2(H2) ; ②△H<0;③250℃
⑶ CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-725.76 kJ / mol
⑷ 负极CH3OH -6e-+8OH-=CO32-+6H2O ; 产生标准状况下的O216.8升
题目分析:A. CH3OH是生成物,而CO是反应物,在任何时刻都存在生成CH3OH的速率与消耗CO的速率相等,因此不能作为判断平衡的标志。错误。B. 由于反应是在体积固定的密闭容器中进行,反应前后遵循质量守恒定律,所以在无论反应是否达到平衡,混合气体的密度都不变。因此不能作为判断平衡的标志。错误。C. 由于该反应是个反应前后气体体积不等的可逆反应,若未达到平衡,气体的物质的量就要发生变化,则气体的密度也要发生变化,即混合气体的相对平均分子质量也要发生变化。因此混合气体的相对平均分子质量不变。可以作为判断反应达到平衡的标志。正确。D. 若反应达到平衡,反应混合物中CH3OH、CO、H2的任何一个组分的消耗浓度与产生浓度相等,即浓度都不再发生变化。因此可以作为判断反应达到平衡的标志。正确。⑵ ①化学平衡常数是可能反应达到平衡状态时各生成物浓度幂指数的乘积与各反应物浓度幂指数的乘积的比。所以 。②由表中数据可知:升高温度,化学平衡常数减小。说明升高温度,化学平衡逆向移动。根据平衡移动原理:升高温度化学平衡向吸热反应方向移动。逆反应方向为吸热反应方向,所以该反应的正反应为放热反应,△H<0。③CO(g)+2H2(g)
。②由表中数据可知:升高温度,化学平衡常数减小。说明升高温度,化学平衡逆向移动。根据平衡移动原理:升高温度化学平衡向吸热反应方向移动。逆反应方向为吸热反应方向,所以该反应的正反应为放热反应,△H<0。③CO(g)+2H2(g) CH3OH(g)在反应开始时c(CO)=1mol/L;c(H2)=3mol/L;c(CH3OH)=0mol/L;当反应达到平衡时,C(CO)=0.2mol/L,所以根据方程式中各种物质的关系可知c(H2)=1.4mol/L;c(CH3OH)= 0.8mol/L化学平衡常数
CH3OH(g)在反应开始时c(CO)=1mol/L;c(H2)=3mol/L;c(CH3OH)=0mol/L;当反应达到平衡时,C(CO)=0.2mol/L,所以根据方程式中各种物质的关系可知c(H2)=1.4mol/L;c(CH3OH)= 0.8mol/L化学平衡常数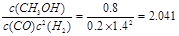 所以反应温度为250℃。(3)燃烧热是1mol的物质完全燃烧产生稳定的氧化物时放出的热量。根据题目提供的数据可知:表示甲醇燃烧热的热化学方程式为CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-725.76 kJ / mol;(4)在燃料电池中,通入燃料的电极为负极,通入氧气的电极为正极。由于电解质为碱性,所以在负极的电极反应式为CH3OH -6e-+8OH-=CO32-+6H2O。n(CH3OH)=16g÷32g/mol=0.5mol.所以n(e-)=0.5mol×6=3mol.根据电子守恒可得n(O2)=3mol÷4=0.75mol,V(O2)= 0.75mol×22.4L/mol=16.8L。
所以反应温度为250℃。(3)燃烧热是1mol的物质完全燃烧产生稳定的氧化物时放出的热量。根据题目提供的数据可知:表示甲醇燃烧热的热化学方程式为CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-725.76 kJ / mol;(4)在燃料电池中,通入燃料的电极为负极,通入氧气的电极为正极。由于电解质为碱性,所以在负极的电极反应式为CH3OH -6e-+8OH-=CO32-+6H2O。n(CH3OH)=16g÷32g/mol=0.5mol.所以n(e-)=0.5mol×6=3mol.根据电子守恒可得n(O2)=3mol÷4=0.75mol,V(O2)= 0.75mol×22.4L/mol=16.8L。
