一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g)

FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)=______.
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是______(填序号).
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,则CO2的转化率将______(填“增大”、“减小”、“不变”)
(4)铁的重要化合物在生产生活中应用十分广泛.
①FeSO4溶液与稍过量的NH4HCO3溶液混合,可得含FeCO3的浊液.若FeCO3浊液长时间暴露在空气中,固体表面会变为红褐色,写出由FeCO3生成红褐色物质的反应的化学方程式:______.
②高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂.高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为______.
(5)已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol;2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol.写出CO和H2O(g)作用生成CO2和H2的热化学方程式______.
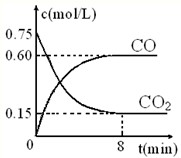
(1)8min内,CO的平均反应速率v(CO)=
=0.075mol•L-1•min-1,故答案为:0.075mol•L-1•min-1;0.6mol/L 8min
(2)A.该反应正反应为吸热反应,升高温度,平衡向正反应进行,c(CO)增大c(CO2)减小,所以 c(CO)/c(CO2)的值增大,故A正确;
B.该反应反应前后气体的体积不变,增大压强平衡不移动,c(CO)/c(CO2)的值不变,故B错误;
C.恒温恒容,充入一定量氮气,c(CO)、c(CO2)不变,平衡不移动,c(CO)/c(CO2)的值不变,故C错误;
D.铁粉为固体,浓度为定值,增加铁粉的用量,不影响平衡,c(CO)/c(CO2)的值不变,故D错误;
故答案为:A;
(3)保持容器体积不变时,再通入一定量的CO2,可等效为开始一次性加入CO2,压强增大,反应前后气体体积不变,平衡不移动,CO2转化率不变,
故答案为:不变;
(4)①FeCO3浊液长时间暴露在空气中,水解氧化生成氢氧化铁和二氧化碳,反应方程式为4FeCO3+O2+6H2O═4Fe(OH)3+4CO2,
故答案为:4FeCO3+O2+6H2O═4Fe(OH)3+4CO2;
②强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,根据电荷守恒、电子转移守恒、原子守恒可知另一种常见化合物含有H元素,应为水,
离子方程式为2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,
故答案为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O;
(5)已知:①2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol;
②2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol.
根据盖斯定律①-②得2CO(g)+2H2O(g)═2CO2(g)+2H2(g)△H=-82.4 kJ/mol,
即CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2 kJ/mol,
故答案为:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2 kJ/mol.
