在恒温恒容的密闭容器中通入lmoIN2和XmolH2,发生如下反应:N2(g)+3H2(g)
2NH3(g)催化剂 高温、高压
已知:①反应过程能量变化如右图;②达到平衡时,测得反应放出的热量为18.4KJ,混合气体物质的量为3.6moL,容器内压强减小10%;
请回答下列问题:
(1)图中A点表示______;C点表示______;
(2)该反应通常使用铁为主体的复合催化剂,使用该催化剂时,B点的变化是______(填“升高”或“降低”)
(3)X值为______;
(4)该反应的热化学方程为______;
(5)若起始时充入的N2、H2、NH3物质的量分别为a、b、c,平衡时各组分的量与上述平衡均相等,且始终维持反应向正方向进行,则起始时c的取值范围为______.
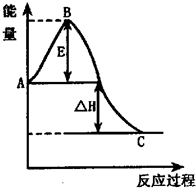
(1)从能量变化图可知,A点代表反应物具有的总能量,C点代表生成物具有的总能量,故答案为:反应物具有的总能量 生成物具有的总能量;
(2)使用催化剂,降低了反应所需活化能,活化分子百分数增加,反应速率加快,故答案为:降低;
(3)根据压强之比等于物质的量之比得:
×100%=10%,解得X=3,故答案为:3;1+X-3.6 1+X
(4)根据方程式计算△H
物质的量变化为:1+3-3.6=0.4,放出18.4KJ能量,物质的量变化为:1+3-2=2时,对应的能量变化为X
N2(g)+3H2(g)⇌2NH3(g)△n∽Q
1 3 2 2 X
0.4 0.4 18.4
X=
=92,即△H=-92kJ/moL.故答案为:N2(g)+3H2(g)⇌2NH3(g)△H=-92kJ/moL;2×18.4 0.4
(5)根据(4)可知,平衡时NH3的物质的量等于0.4mol,要满足平衡正向移动,则NH3的物质的量应小于0.4mol,
故答案为:O≤C<0.4.
