(13分)CH3CHO是有毒物质,易溶于水,含高浓度CH3CHO的废水可以用隔膜电解法处理,总反应为:
2CH3CHO(l) + H2O(l)  CH3CH2OH(l) + CH3COOH(l) ;△H
CH3CH2OH(l) + CH3COOH(l) ;△H
(1)依次写出该反应中三个有机物的官能团名称_____、_______、_______(每空1分)
(2)已知CH3CH2OH、CH3CHO、CH3COOH的燃烧热分别为1366.8 kJ/mol、1166.4kJ/mol、874.8kJ/mol,则△H=_____________
(3)现在实验室中模拟乙醛废水的处理过程,模拟废水为一定浓度的乙醛—Na2SO4溶液,其装置示意图如下图所示。
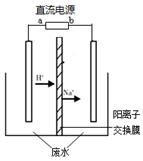
①b是直流电源的______极。
②Na2SO4的作用是_______________________________________。
③阳极除去乙醛的电极反应为
(4)在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛的含量为3000 mg/L的废水,可得到乙醇 kg(计算结果保留小数点后1位)。
(1) 醛基、羟基、羧基 (2)-91.2kJ/mol
(3)负 增强溶液的导电性 (或辅助电解质)。 CH3CHO-2e-+H2O=CH3COOH+2H+
(4)1.9
题目分析:(1)该反应中的三个有机物分别是乙醛、乙醇和乙酸,官能团分别是醛基、羟基和羧基。(2)根据盖斯定律可知ΔH等于乙醛燃烧热的2倍减去乙醇的燃烧热和乙酸的燃烧热之和,所以ΔH="2(-1166.4kJ/mol)-(" 1366.8 kJ/mol)-(- 874.8kJ/mol)="-91.2" kJ/mol。(3)阳离子向阴极移动,根据阳离子的转移方向,可知b是负极,a是正极,因为乙醛不是电解质,水溶液不导电,所以Na2SO4的作用是增强溶液的导电性。阳极发生氧化反应,电极反应为:CH3CHO-2e-+H2O=CH3COOH+2H+。(4)1 m3废水中含乙醛3000mg/L×10-3×1m3×103=3000g,则乙醛的物质的量为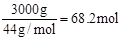 ,因为乙醛的去除率为60%,则生成乙醇68.2mol× 60%=40.9mol,质量为40.9mol×46g/mol=1882g≈1.9kg。
,因为乙醛的去除率为60%,则生成乙醇68.2mol× 60%=40.9mol,质量为40.9mol×46g/mol=1882g≈1.9kg。
点评:本题综合性强,考查电解有机物的反应,锻炼学生分析问题解决问题的能力。

