最近几年我国已加大对氮氧化物排放的控制力度。消除氮氧化物污染有多种方法。
(l)用CH4还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
②CH4(g)+4NO (g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
③H2O(g)= H2O(l) △H=-44.0kJ·mol-1
CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式为 。
(2)用活性炭还原法也可处理氮氧化物。有关反应为:2C(s)+2NO2(g)=N2(g)+2CO2(g) △H<0,起始时向密闭容器中充入一定量的C(s)和NO2(g),在不同条件下,测得各物质的浓度变化状况如下图所示。
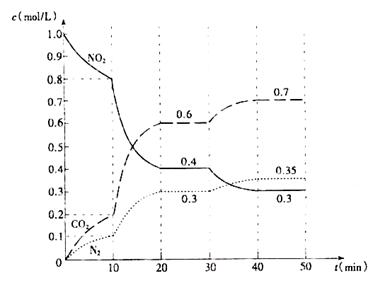
①0〜10min内,以CO2表示的平均反应速率v(CO2)= 。
②0~10min,10〜20 min,30〜40 min三个阶段NO2的转化率分别为α1、α2、α3,其中最小的为 ,其值是 。
③计算反应达到第一次平衡时的平衡常数K= 。
④第10min时,若只改变了影响反应的一个条件,则改变的条件为 (填选项字母)。
A.增加C(s)的量 B.减小容器体积 C.加入催化剂
⑤20~30min、40〜50 min时体系的温度分别为T1和T2,则T1_____T2(填“> “<”或“=”), 判断的理由是 。
(1)CH4(g ) +2NO2 ( g ) =N2 ( g )+ CO2 (g ) +2H2O (l ) ΔH= -955 kJ /mol (2分,只要有错该空即不能得分。)
(2)①0.02 mol/(L· min) (2分,数值、单位各1分)
②α1 (1分) 20% (2分)
③ 0.675 (2分,不写单位不扣分,写错单位扣1分)
④ C (2分)
⑤ > (1分) 此反应为放热反应,降低温度,平衡向正反应方向移动(2分,平衡正向移动、该反应为放热反应两个给分点,各1分。)
题目分析:(1)根据盖斯定律,方程式①+②-③×4可得目标方程式,反应热作相应变化即可。
(2)①根据图像,10min时CO2的浓度为0.2mol/L,则以CO2表示的反应速率为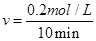 =0.02mol/(L·min)。
=0.02mol/(L·min)。
②根据图像,0~10min内,NO2的转化率α1=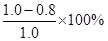 =20%
=20%
10~20min内,NO2的转化率α2=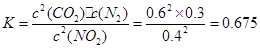 =50%
=50%
30~40min内,NO2的转化率α3=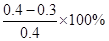 =25%
=25%
③反应在20min时达到平衡,根据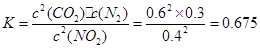 。
。
④根据图像,10~20min内反应速率加快,平衡仍正向移动。增加固体C不影响反应速率,A错;减小容器体积,则增大压强,平衡逆向移动,B错;加入催化剂可加快反应速率,但不影响平衡,C正确。
⑤20~30min、40〜50 min是体系的两个平衡状态,由题意可知改变温度使平衡发生移动,40〜50 min时的平衡与20~30min时的平衡相比,平衡正向移动,因反应是放热反应,故降低温度平衡正向移动,T1>T2。
