2013年全国各地都遭遇“十面霾伏”。其中,机动车尾气和燃煤产生的烟气对空气质量恶化贡献较大。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)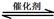 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(2)机动车尾气和煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
(3)用NH3催化还原NOX也可以消除氮氧化物的污染。如图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),
反应原理为:NO(g) +NO2(g)+2NH3(g) 2N2(g) + 3H2O(g)。
2N2(g) + 3H2O(g)。
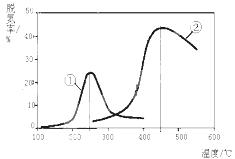
①该反应的△S 0,△H 0(填“>”、“=”或 “<”)。
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),
则上述反应的KP= 。
③以下说法正确的是 。
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
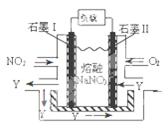
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为 。
(5)硝酸工业尾气中氮氧化物(NO和NO2)可用尿素〔CO(NH2)2〕溶液除去。反应生成对大气无污染的气体。1 mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1:1)的质量为___________g。
(1) bd (各1分,共2分,选错不得分)
(2)CH4(g)+N2O4(g) =N2(g) +2H2O(g) + CO2(l) △H=" —898.1kJ/mol" (2分)
(3)① >(1分) <(1分)②KP= (2分) ; ③ C(2分)
(2分) ; ③ C(2分)
(4)NO2+NO3— —e-=N2O5 (2分)
(5)76g(2分)
题目分析:(1)a、正反应速率等于逆反应速率时,达到平衡状态,此时反应速率不再变化,所以图像不符合,错误;b、因为容器为绝热,所以t1时平衡常数不变,说明反应已达到平衡,正确;c、t1时CO、CO2的物质的量还在变化,没有达到平衡状态,错误;d、t1时NO的质量分数不再变化,说明反应已达到平衡,正确。
(2)首先写出化学方程式并注明状态,然后根据盖斯定律求出焓变,△H=∆H1-∆H2+2×∆H3= —898.1kJ•mol‾1,可写出热化学方程式。
(3)①、根据化学方程式可知气体的系数增大,说明∆S>0;脱氨率达到最高点之后继续升高温度,脱氨率降低,说明平衡向逆反应方向移动,则正反应为放热反应,∆H<0。
②、根据化学方程式中物质的状态和系数可得:KP=
③A、两种催化剂在本题温度时脱氮率不同,错误;B、改变压强,化学平衡移动,脱氮率发生变化,错误;
C、催化剂①在250℃时脱氮率最高,催化剂②在450℃左右脱氮率最高,正确。
(4)燃料电池中O2在正极上发生得电子反应,则NO2在负极上失电子生成更高价态的N2O5,电极方程式为:NO2+NO3— —e-= N2O5
(5)尿素吸收NO、NO2生成对大气无污染的气体,则化学方程式为:CO(NH2)2 + NO +NO2 =2N2 +CO2+2H2O,1mol尿素反应吸收1mol NO和1mol NO2,质量为:30g+46g=76g。
