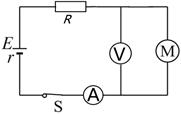
问题
综合
读俄罗斯图完成下列各题:
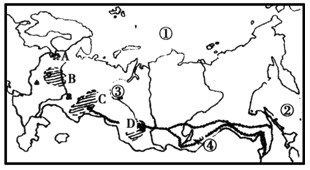
(2)工业区:A________,B________,C________,D________。
(3)铁路:________。
(4)河流:③________;湖泊:④________。
(5)在下表中自西向东填写出俄罗斯的四个地形区的名称及其分界线:

(7)图中所示国家是传统上的________(大洲)国家,比较发达的是________工业。
答案
(1)北冰洋;太平洋
(2)圣彼得堡工业区;莫斯科工业区;乌拉尔工业区;新西伯利亚工业区
(3)西伯利亚大铁路
(4)鄂毕河;贝加尔湖
(5)东欧平原;乌拉尔山脉;西西伯利亚平原;叶尼塞河;中西伯利亚高原;勒拿河;东西伯利亚山地
(6)冬季漫长而寒冷,夏季短促而凉爽
(7)欧洲;重