实验室可由软锰矿(主要成分为MnO2制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。 请回答:
(1)软锰矿制备K2MnO4的化学方程式是__________________ ;
(2)K2MnO4制备KMnO4的离子方程式是_____________________;
(3)若用2.5g软锰矿(含MnO280%)进行上述实验,计算KMnO4的理论产量;
(4)KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2,该反应的化学方程式是________________________;
(5)上述制得的KMnO4产品0.165g,恰好与0.335g钝Na2C2O4反应完全,计算该KMnO4的纯度。
(1)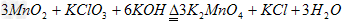
(2)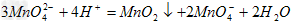
(3)根据(1)和(2)中的两个方程式可以得到关系式:
3MnO2————2KMnO4
3×87 2×158
2.5g×80% m(KMnO4)
m(KMnO4)=2×158×2.5g×80%/(3×87)=2.4g
(4)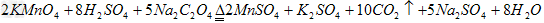
(5)根据(4)中的化学方程式:
2KMnO4—————5Na2C2O4
2×158 5×134
m(KMnO4) 0.335g
m(KMnO4)=2×158×0.335g/(5×134)=0.158g
KMnO4纯度=(0.158g/0.165g)×100%=95.8%
