以废铁屑为原料生产莫尔盐的主要流程如下
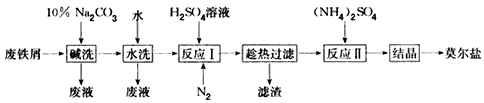
(1)“反应I”中通入N2的作用是____________。
(2)称取23. 52 g新制莫尔盐,溶于水配制成100 mL溶液,将所得溶液分成两等份。
一份加入足量Ba(OH)2溶液,并微热,逸出能使湿润的红色石蕊试纸变蓝的气体,同时生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;用足量稀盐酸处理沉淀物,充分反应后过滤、洗涤和干燥,得白色固体13. 98 g。
另一份用 0. 200 0 mol/LK2Cr2O7酸性溶液滴定,当CrO72-恰好完全被还原为Cr3+时,消耗K2Cr2O7溶液的体积为25. 00 mL。通过计算确定莫尔盐的化学式。
(3)若将“水洗”这一步去掉,则所得产品中的SO42-的质量分数会____________(填 “偏大”“偏小”或“不变”)。
(1)防止Fe2+被氧化为Fe3+,且起搅拌作用,以加快反应速率
(2)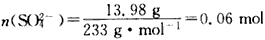
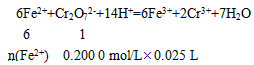
n(Fe2+)=0. 005 mol×6=0. 03 mol
n(NH4+)+2n(Fe2+)=2n(SO42-),n(NH4+)=0. 06 mol
n(H2O)= =0.18 mol
=0.18 mol
n(SO42-):n(Fe2+):n(NH4+):n(H2O)= 0.06 mol:0.03 mol:0. 06 mol:0.18 mol=2:1:2:6
奠尔盐的化学式为(NH4)2Fe(SO4)2·6H2O [或(NH4)2SO4·FeSO4·6H2O]
(3)偏小
