问题
选择题
已知乙炔与苯蒸气完全燃烧的热化学方程式如下:
①C2H2(g)+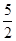 O2(g)―→2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1
O2(g)―→2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1
②C6H6(g)+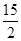 O2(g)―→6CO2(g)+3H2O(l) ΔH=-3 295 kJ·mol-1
O2(g)―→6CO2(g)+3H2O(l) ΔH=-3 295 kJ·mol-1
下列说法正确的是 ( )。
A.1 mol C2H2(g)完全燃烧生成气态水时放热大于1 300 kJ
B.1 mol C6H6(l)完全燃烧生成液态水时放热大于3 295 kJ
C.相同条件下,等质量的C2H2(g)与C6H6(g)完全燃烧,C6H6(g)放热更多
D.C2H2(g)三聚生成C6H6(g)的过程属于放热反应
答案
答案:D
液态水生成气态水要吸热,则A中放热应小于1 300 kJ,错误;液态苯的能量比气态苯的能量低,则B中放出热量应小于3 295 kJ,B错误;通过计算可知等质量的两者完全燃烧时乙炔放热多,C错误;根据盖斯定律,由3×①-②得:3C2H2(g)=C6H6(g) ΔH=-605 kJ·mol-1,D正确。
