氮元素的化合物种类繁多,性质也各不相同。
(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:
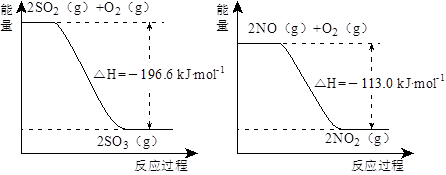
则NO2氧化SO2的热化学方程式为_________________________________。
(2)在2L密闭容器中放入1mol氨气,在一定温度进行如下反应:
2NH3(g)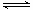 N2(g)+3H2(g),反应时间(t)与容器内气体总压强(p)的数据见下表
N2(g)+3H2(g),反应时间(t)与容器内气体总压强(p)的数据见下表
| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强p 100 kPa | 5 | 5.6 | 6.4 | 6.8 | 7 | 7 |
则平衡时氨气的转化率为___________。
(3)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。在空气中完全燃烧生成氮气,当反应转移0.2mol电子时,生成气体在标准状况下的体积为______________。联氨溶于水可以发生与氨水类似的电离,试写出联氨在水溶液中的电离方程式:
__________________(写一步即可)。
(4)NH4+在溶液中能发生水解反应。在25℃时,0.1mol/L氯化铵溶液由水电离出的氢离子浓度为1×10-5 mol/L,则在该温度下此溶液中氨水的电离平衡常数Kb(NH3·H2O)=__________________。
(1)NO2(g)+SO2(g)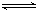 SO3(g)+NO(g) ΔH=-41.8kJ/mol(2分)
SO3(g)+NO(g) ΔH=-41.8kJ/mol(2分)
(2)40%(2分)
(3) 1.12L(2分);N2H4+H2O N2H5++OH- (2分)
N2H5++OH- (2分)
(4) Kb(NH3·H2O)=1×10-5mol/L(2分)
题目分析:(1)根据图1可得:2SO2(g)+O2(g)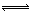 2SO3(g) ΔH=-196.6kJ•mol‾1,根据图2可得:2NO(g)+O2(g)=2NO2(g) ΔH=-113.0kJ•mol‾1,根据盖斯定律可得NO2(g)+SO2(g)
2SO3(g) ΔH=-196.6kJ•mol‾1,根据图2可得:2NO(g)+O2(g)=2NO2(g) ΔH=-113.0kJ•mol‾1,根据盖斯定律可得NO2(g)+SO2(g)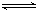 SO3(g)+NO(g) ΔH=1/2ΔH1—1/2ΔH2=-41.8kJ•mol‾1
SO3(g)+NO(g) ΔH=1/2ΔH1—1/2ΔH2=-41.8kJ•mol‾1
(2)气体的压强之比等于物质的量之比,根据三段式进行计算:设氨气的转化率为x
2NH3(g)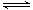 N2(g)+3H2(g)
N2(g)+3H2(g)
起始物质的量(mol) 1 0 0
转化物质的量(mol) x x/2 3/2x
平衡物质的量(mol) 1-x x/2 3/2x
1:(1+x)=5:7,解得x=40%
(3)N2H4转化为N2,N元素由 -2价升高至0价,所以电子转移为:N2H4 ~ N2 ~ 4e‾,n(N2)=1/4n(e‾)=0.05mol,故在标准状况下的体积为1.12L;联氨溶于水可以发生与氨水类似的电离,N2H4与H+形成配位键,所以电离方程式为:N2H4+H2O N2H5++OH-
N2H5++OH-
(4)c(OH‾)=Kw/c(H+)=10-9mol•L‾1,c(NH3•H2O)=c(H+)=10-5mol•L‾1,所以Kb(NH3·H2O)=c(NH4+)•c(OH‾)/c(NH3•H2O)=0.1mol/L×10-9mol•L‾1/10-5mol•L‾1=1×10-5mol/L
